
Stuhluntersuchung, Probenahme, Techniken, Beispiele
Das Stuhluntersuchung ist eine Laborstudie, in der Fäkalien (Fäkalien) untersucht werden, um Darmparasiten zu erkennen. Es ist eine der einfachsten und ältesten Labortechniken, die ursprünglich von Anton Van Leeuwenhoek im 18. Jahrhundert entwickelt wurde..
Anton Van Leeuwenhoek, der als Vater der Mikrobiologie gilt, verwendete die „direkte“ koproparasitisch-toskopische Methode, um seinen eigenen Kot zu beobachten, und beschrieb, welche Jahre später als Trophozoiten von identifiziert wurden Giardia lamblia, ein Protozoon, das in den Dünndarm des Menschen eindringt.
Parasitäre Krankheiten betreffen Millionen von Menschen auf der Welt, insbesondere in armen oder unterentwickelten Ländern, in denen schlechte hygienische Bedingungen im Zusammenhang mit der Entsorgung von Ausscheidungen und dem Verbrauch von kontaminiertem Wasser bestehen..
Die Diagnose dieser Krankheiten ist wichtig für eine adäquate Behandlung, da die koproparasitoskopische Untersuchung ein unverzichtbares Instrument dafür ist. Es ist ein einfacher, schneller und kostengünstiger Labortest.
Die Stuhluntersuchung umfasst mehrere Techniken, die neben der direkten Visualisierung und Quantifizierung von Eiern, Trophozoiten, Zysten oder Larven auch die Identifizierung der Strukturen des Mikroorganismus und damit die Identifizierung des Parasiten ermöglichen..
Zu den für die Stuhluntersuchung verwendeten Techniken gehören Methylenblau-Färbetechniken, Konzentrationsmethoden, Faust-, Richie-Techniken, Sedimentationstechniken sowie direkte, Einzel- oder Serienuntersuchungen..
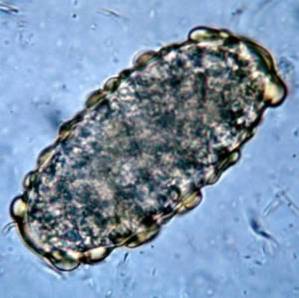
Artikelverzeichnis
- 1 Probensammlung
- 2 Techniken
- 2.1 Direkte Prüfungen
- 2.2 Suspensions- und Konzentrationstechniken
- 3 Beispiele
- 4 Referenzen
Probenahme
Um diese Studie durchzuführen, muss der Patient eine frische Stuhlprobe entnehmen, die nicht mit Urin, Wasser, Blut (Menstruation) oder Erde kontaminiert ist. Die Probe muss die Größe einer Walnuss haben oder, wenn sie flüssig ist, mindestens das Volumen haben, das zwei Esslöffeln entspricht.
Der Patient darf mindestens drei Tage vor der Probenentnahme oder für den von seinem Arzt angegebenen Zeitraum keine Parasitizide eingenommen haben. Sie sollten auch keine Abführmittel verwenden.
Die Proben sollten in einen trockenen Behälter mit weitem Mund und Deckel oder in einen speziell entwickelten Einwegbehälter (erhältlich in Ihrer bevorzugten Apotheke) gegeben werden. Die Proben sollten in einer kühlen Umgebung aufbewahrt, nicht länger als 24 Stunden gekühlt und nicht in der Nähe von Wärmequellen gelagert oder gefroren werden.
Wenn die angegebene Untersuchung seriell ist, sind mindestens drei Proben erforderlich, die alle 24 Stunden oder länger entnommen werden müssen, wie vom Arzt angegeben. Für diese Fälle stellen Laboratorien im Allgemeinen einen Satz Kolben bereit, die Lösungen mit Konservierungsmitteln enthalten..
Wenn der Patient einen "Wurm" im Stuhl beobachtet, sollte er ihn nach Möglichkeit in eine geschlossene Flasche mit Wasser legen und zusammen mit der Flasche der Stuhlprobe ins Labor bringen..
Die Fläschchen mit den Proben oder mit den "Würmern" müssen gekennzeichnet und mit dem Namen des Patienten, seinem Alter, Geschlecht sowie Datum und Uhrzeit der Probenentnahme gekennzeichnet sein..
Es ist sehr wichtig, den Patienten in all diesen Aspekten der Probenahme und -handhabung angemessen zu unterweisen, da dies davon abhängt, ob die in dieser Probe vorhandenen Elemente für die Beobachtung, Identifizierung und Diagnose lebensfähig bleiben..
Techniken
Es gibt direkte Stuhltests sowie Probensuspensions- und Konzentrationstechniken, die häufig angewendet werden, um falsch negative Ergebnisse zu vermeiden und viel sauberere Proben zu beobachten. Einige Färbetechniken werden auch verwendet, um bestimmte Parasiten zu identifizieren..
Direkte Prüfungen
Die direkte Stuhluntersuchung nach der Technik von Ohrring fallen lassen, besteht darin, die Stuhlprobe mit physiologischer Lösung (0,9% NaCl) zu verdünnen und einen Tropfen dieser Lösung in eine Konkavität zu geben, für die ein spezieller Objektträger verwendet wird.
Sobald der Tropfen auf dem Objektträger platziert ist, wird er mit einem Deckglas abgedeckt und unter dem Mikroskop beobachtet. Diese Technik ermöglicht es uns, Eier und Zysten zu beobachten, aber sie ermöglicht es uns auch, jedes mobile Element wie Flagellaten, Larven, Trophozoiten, Ciliaten usw. zu beobachten..
Suspensions- und Konzentrationstechniken
Suspensionstechniken verwenden eine Lösung, die dichter als die zu beobachtenden Elemente ist, so dass diese auf der Oberfläche der Flüssigkeit schwimmen und gesammelt werden können, da sie in der Oberflächenschicht der Lösung konzentriert bleiben..
Diese Technik hat den Vorteil, dass eine ziemlich saubere Schmutzprobe möglich ist, da diese, da sie dichter sind, am Boden der Flasche verbleiben. Der relative Nachteil besteht darin, dass die Lösung in kurzer Zeit schrumpft und die Mikroorganismen verformt.
Diese Methoden werden nicht für Helminthen- und Cestodeneier verwendet, da sie sehr schwer sind und in diesen Lösungen nicht schwimmen. Sie werden häufig verwendet, um Protozoen in ihrer tropozoischen Form oder in ihren Eiern zu beobachten und um Larven wie die von zu beobachten Strongyloides stercoralis.
Eine andere Technik, die weit verbreitet ist, weil sie die Mikroorganismen in der Probe nicht verformt und einfach und kostengünstig ist, ist die Formalinsedimentationstechnik..
Unter den Konzentrationstechniken können wir als Beispiel die Techniken von Faust und Richie anführen.
Die verschiedenen Techniken, die die mikroskopische Visualisierung der Eier, Larven oder anderer Elemente der verschiedenen Darmparasiten ermöglichen, ermöglichen in Kombination mit den Färbetechniken die Identifizierung und Diagnose dieser Krankheiten..
Beispiele
Als nächstes wird ein klinischer Fall beschrieben und einige Bilder werden gezeigt, die die Nützlichkeit der Stuhluntersuchung für die Diagnose und die Bewertung des Nutzens der Behandlung veranschaulichen..
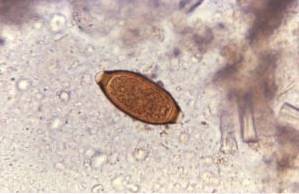
Ein 18-jähriger männlicher Patient kommt wegen kolikartiger Bauchschmerzen, die im periumbilikalen Bereich stärker sind, Übelkeit und Episoden von wässrigem Durchfall in die Arztpraxis.
Bei der Befragung des Patienten stellt der Arzt zwei hervorstechende Punkte fest: 1) Der Patient bezieht sich auf das Baden in einem See in einer ländlichen Gegend und 2) er ist beeindruckt von der Tatsache, dass sein Kot in der Toilette schwimmt. Nach der Untersuchung des Patienten vermutet der Arzt das Vorhandensein von Giardia lamblia.
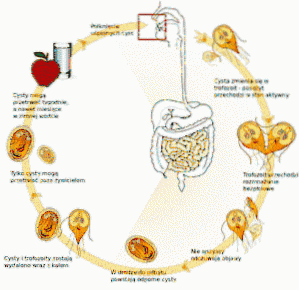
Dieses Protozoon lebt im Dünndarm des Menschen und stört die Aufnahme von Fetten, wodurch sehr fettige Stühle entstehen, die zum Schweben neigen. Verschmutzungen treten häufig durch verschmutztes Wasser in Seen oder Bächen in ländlichen Gebieten oder in Pools oder Whirlpools mit schlechter Wartung auf.
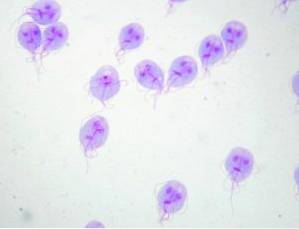
Der Arzt gibt eine Stuhluntersuchung an und die Ergebnisse bestätigen das Vorhandensein von Giardia lamblia. Nach dem Ende der Behandlung ist eine weitere Stuhluntersuchung angezeigt, die das Fehlen von Zysten oder Trophozoiten bestätigt Giardia lamblia.
Verweise
- D. Buonfrate, M. A. Mena, A. Angheben, A. Requena-Mendez, J. Muñoz, F. Gobbi,… & COHEMI Project Study Group. (2015). Prävalenz der Strongyloidiasis in Lateinamerika: eine systematische Überprüfung der Literatur. Epidemiologie & Infektion, 143(3), 452 & ndash; 460.
- de Haro Arteaga, I. & Ruiz, A.E.C. (2014). Diagnose von. Medizinische Parasitologie (4 .., 347.
- D. Mendoza, F. A. Nunez, A. A. Escobedo, L. Pelayo, M. Fernandez, D. Torres & R. A. Cordovi (2003). Nützlichkeit von 2 koproparasitologischen Methoden und deren Verwendung in einer therapeutischen Studie gegen Antigiardiasis. Kubanische Zeitschrift für Tropenmedizin, 55(3), 174-178.
- Preis, -D. L. (2017). Verfahrenshandbuch zur Diagnose von Darmparasiten. CRC Drücken Sie.
- Sahin, I., Kiliç, H., Ozca, M. & Orhan, R. (1984). Eine koproparasitologische Studie über die Wrestler der Nationalmannschaft. Mikrobiyoloji bülteni, 18(2), 114-118.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.