
Natriumoxid (Na2O) -Struktur, Formel, Eigenschaften, Risiken

Das Natriumoxid ist eine anorganische Verbindung der Formel NazweiO. Wie alle Alkalimetalloxide hat es eine kristalline Struktur ähnlich wie Antifluorit (ähnlich wie Fluorit, CaF2, jedoch mit umgekehrten Kationen und Anionen), die einer flächenzentrierten kubischen Struktur entspricht. (Natrium: Dinatriumoxid, 1993-2016).
Man könnte sagen, dass Natriumoxid das Anhydrid von Natriumhydroxid ist, da es mit Wasser unter Bildung von zwei Mol dieser Verbindung auf folgende Weise reagiert:
N / AzweiO + H.zweiO → 2NaOH
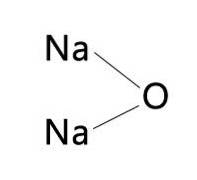
Im Allgemeinen kann der Name KNaO geschrieben gefunden werden und bezieht sich auf Natriumoxid oder Kaliumoxid. Dies liegt daran, dass die beiden Oxide ähnliche Eigenschaften hinsichtlich Farbe und Expansions- und Kontraktionsraten aufweisen..
Unlösliche Natriumoxidquellen sind häufig Spuren von Kaliumoxid, beispielsweise in Feldspaten (Abbildung 2), die in bestimmten Emails die Hauptquelle für Natrium darstellen (Britt, 2007)..

Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften
Natriumoxid ist ein weißer kristalliner Feststoff (Abbildung 3). Es hat ein Molekulargewicht von 61,98 g / mol, eine Dichte von 2,27 g / ml und einen Schmelzpunkt von 1275ºC..
Die Verbindung hat einen Siedepunkt von 1950 ° C, wo sie sich zu Natriumperoxid und metallischem Natrium zu zersetzen beginnt. Eine interessante Eigenschaft ist jedoch, dass Natriumoxid bei 1100 ° C zu sublimieren beginnt (Nationales Zentrum für Biotechnologie-Informationen, SF)..

Reagiert heftig mit Wasser und Alkohol unter Bildung von Natriumhydroxid. Natriumoxid, NazweiOder es absorbiert reversibel Wasserstoff (H.zwei), um Natriumhydrid (NaH) und Natriumhydroxid (NaOH) zu bilden, die möglicherweise ihre Anwendung bei der reversiblen Speicherung von Wasserstoff finden.
Reaktivität und Gefahren
Natriumoxid ist eine stabile nicht brennbare Verbindung, kann jedoch heftig mit Säuren und Wasser reagieren. Es kann auch die Verbrennung anderer Substanzen erhöhen. Es ist als ätzend eingestuft und kann Haut und Augen verbrennen (Royal Society of Chemistry, 2015)..
Die Lösung in Wasser ist eine starke Base, da sie heftig mit ätzenden Säuren reagiert. Bei heftiger Reaktion mit Wasser entsteht Natriumhydroxid, das in Gegenwart von Wasser viele Metalle angreift.
Die Substanz ist auch ätzend für die Atemwege und beim Verschlucken. Das Einatmen von Aerosol kann zu Lungenödemen führen (Nationales Institut für Sicherheit und Gesundheitsschutz am Arbeitsplatz, 2014)..
Bei Inhalation sollte die betroffene Person an einen kühlen Ort gebracht werden. Wenn das Opfer nicht atmet, sollte künstlich beatmet werden. Später gehen Sie oder konsultieren Sie so schnell wie möglich einen Arzt.
Bei Hautkontakt sollten kontaminierte Kleidung und Schuhe sofort entfernt und mit viel Wasser gewaschen werden..
Bei Kontakt mit den Augen mindestens 15 Minuten lang mit viel Wasser abspülen und einen Arzt konsultieren. Bei Verschlucken kein Erbrechen herbeiführen, sondern den Mund mit Wasser ausspülen und einen Arzt konsultieren..
Die wichtigsten Symptome und Wirkungen können sein: Krämpfe, Entzündungen und Ödeme des Kehlkopfes und der Bronchien, Pneumonitis, Lungenödem, Brennen, Husten, Keuchen, Kehlkopfentzündung und Atembeschwerden (Natriumoxid (Na2O) (cas 1313-59-3) ) Sicherheitsdatenblatt, 2010-2017).
Die Symptome eines Lungenödems treten oft erst nach einigen Stunden auf und werden durch körperliche Anstrengung verschlimmert. Ruhe und ärztliche Beobachtung sind daher unerlässlich.
Natriumoxid sollte an einem trockenen Ort gelagert und von starken Säuren getrennt werden. Da die Verbindung heftig mit Wasser reagiert, sollten im Brandfall keine Feuerlöscher oder Sprinkler auf Wasserbasis verwendet werden. Es wird empfohlen, trockenes Pulver oder Sand zu verwenden.
Anwendungen
Natriumoxid wird hauptsächlich zur Herstellung von Glas verwendet. Es wird in Keramik und Gläsern verwendet, wenn auch nicht in roher Form. Natriumoxid macht im Allgemeinen etwa 15% der chemischen Zusammensetzung von Glas aus.
Es reduziert die Temperatur, bei der Siliziumdioxid schmilzt (70% Glaszusammensetzung), was dazu führt, dass die Herstellung von Glas billiger und effizienter ist, da der Hersteller weniger Energie verbraucht (George Sumner, nd)..
Natriumkalkglas ist die am häufigsten hergestellte Glasform, die ungefähr 70% Siliciumdioxid (Siliciumdioxid), 15% Soda (Natriumoxid) und 9% Kalk (Calciumoxid) mit viel höheren Mengen enthält. Kleine andere Verbindungen.
Das Natriumoxid dient als Flussmittel, um die Temperatur zu senken, bei der die Kieselsäure schmilzt, und der Kalk wirkt als Stabilisator für die Kieselsäure. Natrium-Kalk-Glas ist billig, chemisch stabil, ziemlich hart und äußerst verarbeitbar, da es bei Bedarf mehrmals erweicht werden kann..
Diese Eigenschaften machen es für die Herstellung einer breiten Palette von Glasprodukten geeignet, einschließlich Glühbirnen, Gläsern, Flaschen und Kunstgegenständen..
Andererseits enthalten Natriumoxid und Siliciumdioxid Wasserkristalle, auch Natriumsilicat oder Wasserglas genannt, die einen glasartigen Feststoff mit der sehr nützlichen Eigenschaft bilden, in Wasser löslich zu sein..
Glas Wasser wird als feste Klumpen oder Pulver oder als klare, sirupartige Flüssigkeit verkauft. Es wird als bequeme Natriumquelle für viele Industrieprodukte verwendet, z. B.: Als Hersteller von Waschmitteln, als Bindemittel und Klebstoff, als Flockungsmittel in Wasseraufbereitungsanlagen und in vielen anderen Anwendungen (Enciclopaedia britannica, 2017)..
Oxidverbindungen leiten keinen Strom. Bestimmte strukturierte Perowskitoxide sind jedoch elektronische Leiter zur Anwendung in der Kathode von Festoxidbrennstoffzellen und Sauerstofferzeugungssystemen (American Elements, 1998-2017)..
Verweise
- Nationales Institut für Arbeitssicherheit und Gesundheit. (2014, 1. Juli). CDC-NATRIUMOXID. Von cdc wiederhergestellt.
- Amerikanische Elemente. (1998-2017). Natriumoxid. Von americanelements.com wiederhergestellt.
- Britt, J. (2007). Der komplette Leitfaden zu Hochfeuerglasuren. New York: Lerchenbücher.
- Britannica-Enzyklopädie. (2017). Natriumoxid chemische Verbindung. Von britannica.com wiederhergestellt.
- George Sumner, D. J. (s.f.). Was sind einige der Anwendungen für Natriumoxid? Von quora.com wiederhergestellt.
- Nationales Zentrum für Informationen zur Biotechnologie. (S.F.). PubChem Compound Database; CID = 73971. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Royal Society of Chemistry. (2015). Natriumoxid. Von chemspider.com wiederhergestellt.
- Ruitao Wang, T. K. (2006). Reaktion von Wasserstoff mit Natriumoxid: Ein reversibles Hydrierungs- / Dehydrierungssystem. Journal of Power Sources, Band 155, Ausgabe 2, 167-171. sciencedirect.com.
- Natriumoxid (Na 2 O) (cas 1313-59-3) Sicherheitsdatenblatt. (2010-2017). Von guidechem wiederhergestellt: guidechem.com.
- Natrium: Dinatriumoxid. (1993-2016). Von webelements wiederhergestellt: webelements.com.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.