
Sphingomyelin Struktur, Funktionen, Synthese und Stoffwechsel
Das Sphingomyelin Es ist das am häufigsten vorkommende Sphingolipid in tierischen Geweben: Es wurde in allen bisher untersuchten Zellmembranen gefunden. Es hat strukturelle Ähnlichkeiten mit Phosphatidylcholin in Bezug auf die polare Kopfgruppe, weshalb es auch als Phospholipid (Phosphosphingolipid) klassifiziert wird..
In den 1880er Jahren isolierte der Wissenschaftler Johann Thudichum eine ätherlösliche Lipidkomponente aus Hirngewebe und nannte sie Sphingomyelin. Später, im Jahr 1927, wurde die Struktur dieses Sphingolipids als berichtet N.-Acyl-Sphingosin-1-phosphocholin.
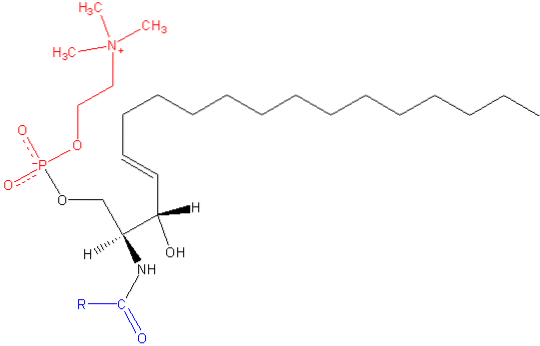
Wie die anderen Sphingolipide hat Sphingomyelin sowohl strukturelle als auch zelluläre Signalfunktionen und kommt besonders häufig in Nervengeweben vor, insbesondere in Myelin, einer Hülle, die die Axone bestimmter Neuronen bedeckt und isoliert.
Seine Verteilung wurde durch Experimente zur subzellulären Fraktionierung und zum enzymatischen Abbau mit Sphingomyelinasen untersucht, und die Ergebnisse zeigen, dass mehr als die Hälfte des Sphingomyelins in eukaryotischen Zellen in der Plasmamembran gefunden wird. Dies hängt jedoch vom Zelltyp ab. Beispielsweise macht es bei Fibroblasten fast 90% der gesamten Lipide aus.
Die Fehlregulation der Synthese- und Stoffwechselprozesse dieses Lipids führt zur Entwicklung komplexer Pathologien oder Lipidosen. Ein Beispiel hierfür ist die erbliche Niemann-Pick-Krankheit, die durch Hepatosplenomegalie und fortschreitende neurologische Dysfunktion gekennzeichnet ist.
Artikelverzeichnis
- 1 Struktur
- 2 Funktionen
- 2.1 -Signage
- 2.2 -Struktur
- 3 Synthese
- 4 Stoffwechsel
- 5 Referenzen
Struktur
Sphingomyelin ist ein amphipathisches Molekül, das aus einem polaren Kopf und zwei unpolaren Schwänzen besteht. Die polare Kopfgruppe ist ein Phosphocholinmolekül, daher kann sie dem Glycerophospholipid Phosphatidylcholin (PC) ähnlich erscheinen. Es gibt jedoch wesentliche Unterschiede hinsichtlich des Grenzflächen- und des hydrophoben Bereichs zwischen diesen beiden Molekülen..
Die häufigste Base in einem Säugetier-Sphingomyelinmolekül ist Ceramid, das aus Sphingosin (1,3-Dihydroxy-2-amino-4-octadecen) besteht und eine Doppelbindung in aufweist trans zwischen den Kohlenstoffen an den Positionen 4 und 5 der Kohlenwasserstoffkette. Sein gesättigtes Derivat, Sphinganin, ist ebenfalls häufig, wird jedoch in geringerem Maße gefunden.
Die Länge der hydrophoben Schwänze von Sphingomyelin reicht von 16 bis 24 Kohlenstoffatomen und die Fettsäurezusammensetzung variiert je nach Gewebe.
Die Sphingomyeline der weißen Substanz des menschlichen Gehirns besitzen beispielsweise Nervonsäure, die der grauen Substanz enthalten hauptsächlich Stearinsäure, und die in Blutplättchen vorherrschende Form ist Arachidonat..
Es gibt im Allgemeinen eine Längenunterschiede zwischen den beiden Fettsäureketten von Sphingomyelin, was "Interdigitalisierungs" -Phänomene zwischen Kohlenwasserstoffen in gegenüberliegenden Monoschichten zu begünstigen scheint. Dies verleiht der Membran eine besondere Stabilität und besondere Eigenschaften im Vergleich zu anderen Membranen, die in diesem Sphingolipid schlechter sind..
Im Grenzflächenbereich des Moleküls hat Sphingomyelin eine Amidgruppe und eine freie Hydroxylgruppe an Kohlenstoff 3, die als Donoren und Akzeptoren von Wasserstoffbrückenbindungen für intra- und intermolekulare Bindungen dienen können, die für die Definition von Seitendomänen und die Wechselwirkung mit verschiedenen wichtig sind Arten von Molekülen.
Eigenschaften
-Signalisierung
Die Produkte des Sphingosinstoffwechsels - Ceramid, Sphingosin, Sphingosin-1-phosphat und Diacylglycerin - sind wichtige zelluläre Effektoren und spielen eine Rolle bei mehreren zellulären Funktionen wie Apoptose, Entwicklung und Alterung, unter anderem bei der Signalübertragung von Zellen..
-Struktur
Dank der dreidimensionalen „zylindrischen“ Struktur von Sphingomyelin kann dieses Lipid kompaktere und geordnete Membrandomänen bilden, was aus Proteinsicht wichtige funktionelle Auswirkungen hat, da es spezifische Domänen für einige integrale Membranproteine festlegen kann.
In Lipid "Flößen" und Caveolae
Lipidflöße, Membranphasen oder geordnete Mikrodomänen von Sphingolipiden wie Sphingomyelin, einigen Glycerophospholipiden und Cholesterin stellen stabile Plattformen für die Assoziation von Membranproteinen mit verschiedenen Funktionen (Rezeptoren, Transporter usw.) dar..
Caveolae sind Invaginationen der Plasmamembran, die Proteine mit GPI-Ankern rekrutieren und außerdem reich an Sphingomyelin sind.
In Bezug auf Cholesterin
Cholesterin beeinflusst aufgrund seiner strukturellen Steifheit die Struktur von Zellmembranen erheblich, insbesondere in Bezug auf die Fließfähigkeit, weshalb es als wesentliches Element angesehen wird.
Da Sphingomyeline sowohl Wasserstoffbrückenbindungsdonoren als auch -akzeptoren besitzen, wird angenommen, dass sie in der Lage sind, „stabilere“ Wechselwirkungen mit Cholesterinmolekülen zu bilden. Aus diesem Grund wird gesagt, dass eine positive Korrelation zwischen den Cholesterin- und Sphingomyelinspiegeln in den Membranen besteht..
Synthese
Die Synthese von Sphingomyelin findet im Golgi-Komplex statt, wo das vom endoplasmatischen Retikulum (ER) transportierte Ceramid durch Übertragung eines Phosphocholinmoleküls von Phosphatidylcholin unter gleichzeitiger Freisetzung eines Diacylglycerinmoleküls modifiziert wird. Die Reaktion wird durch SM-Synthase (Ceramid: Phosphatidylcholin-Phosphocholin-Transferase) katalysiert..
Es gibt auch einen anderen Weg für die Sphingomyelinproduktion, der durch Übertragung eines Phosphoethanolamins von Phosphatidylethanolamin (PE) auf Ceramid mit anschließender Phosphoethanolaminmethylierung auftreten kann. Dies wird als besonders wichtig in einigen PE-reichen Nervengeweben angesehen..
Die Sphingomyelinsynthase befindet sich auf der Lumenseite der Golgi-Komplexmembran, was mit der zusätzlichen zytoplasmatischen Position von Sphingomyelin in den meisten Zellen übereinstimmt.
Aufgrund der Eigenschaften der polaren Gruppe von Sphingomyelin und des offensichtlichen Fehlens spezifischer Translokasen hängt die topologische Orientierung dieses Lipids von der Enzymsynthase ab..
Stoffwechsel
Der Sphingomyelinabbau kann sowohl in der Plasmamembran als auch in den Lysosomen auftreten. Die lysosomale Hydrolyse zu Ceramid und Phosphocholin hängt von der sauren Sphingomyelinase ab, einem löslichen lysosomalen Glykoprotein, dessen Aktivität einen optimalen pH-Wert von etwa 4,5 aufweist.
Die Hydrolyse in der Plasmamembran wird durch eine Sphingomyelinase katalysiert, die bei pH 7,4 arbeitet und für deren Betrieb zweiwertige Magnesium- oder Manganionen benötigt. Andere Enzyme, die am Metabolismus und Recycling von Sphingomyelin beteiligt sind, befinden sich in verschiedenen Organellen, die über vesikuläre Transportwege miteinander verbunden sind..
Verweise
- Y. Barenholz & T. E. Thompson (1999). Sphingomyelin: biophysikalische Aspekte. Chemie und Physik der Lipide, 102, 29-34.
- Kanfer, J. & Hakomori, S. (1983). Sphingolipid-Biochemie. (D. Hanahan, Hrsg.), Handbuch der Lipidforschung 3 (1. Aufl.). Plenumpresse.
- Koval, M. & Pagano, R. (1991). Intrazellulärer Transport und Metabolismus von Sphingomyelin. Biochimic, 1082, 113-125.
- H. Lodish, A. Berk, C. A. Kaiser, M. Krieger, A. Bretscher, H. Ploegh, K. Martin (2003). Molekulare Zellbiologie (5. Aufl.). Freeman, W. H. & Company.
- Millat, G., Chikh, K., Naureckiene, S., Sleat, D. E., Fensom, A. H., Higaki, K.,… Vanier, M. T. (2001). Niemann-Pick-Krankheit Typ C: Spektrum der HE1-Mutationen und Genotyp / Phänotyp-Korrelationen in der NPC2-Gruppe. Am. J. Hum. Genet., 69, 1013-1021.
- B. Ramstedt & P. Slotte (2002). Membraneigenschaften von Sphingomyelinen. FEBS Briefe, 531, 33-37.
- Slotte, P. (1999). Sphingomyelin-Cholesterin-Wechselwirkungen in biologischen und Modellmembranen. Chemie und Physik der Lipide, 102, 13-27.
- Vance, J. E. & Vance, D. E. (2008). Biochemie von Lipiden, Lipoproteinen und Membranen. Im New Comprehensive Biochemistry Vol. 36 (4. Aufl.). Elsevier.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.