
Was ist ein Energiediagramm? (mit Beispielen)

EIN Energiediagramm ist ein Energiediagramm, das den Prozess veranschaulicht, der während einer Reaktion abläuft. Energiediagramme können auch als Visualisierung einer Elektronenkonfiguration in Orbitalen definiert werden. Jede Darstellung ist ein Elektron aus einem Orbital mit einem Pfeil.
In einem Energiediagramm stellen die nach oben zeigenden Pfeile beispielsweise ein Elektron mit einem positiven Spin dar. Die nach unten zeigenden Pfeile sind wiederum für die Darstellung eines Elektrons mit negativem Spin verantwortlich.
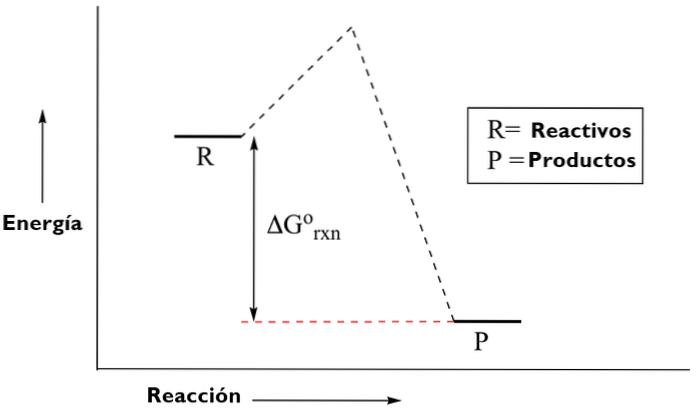
Es gibt zwei Arten von Energiediagrammen. Die Diagramme der Thermodynamik oder der organischen Chemie, die die Menge an Energie zeigen, die während einer Reaktion erzeugt oder verbraucht wird; Ausgehend von den reaktiven Elementen, die einen Übergangszustand durchlaufen, zu den Produkten.
Und anorganische Chemiediagramme, die dazu dienen, Molekülorbitale nach dem Energieniveau der Atome zu demonstrieren.
Arten von Energiediagrammen
Thermodynamische Diagramme
Thermodynamische Diagramme sind Diagramme, die verwendet werden, um die thermodynamischen Zustände einer Materie (typischerweise Flüssigkeiten) und die Folgen des Umgangs mit diesem Material darzustellen.
Beispielsweise kann ein entropisches Temperaturdiagramm verwendet werden, um das Verhalten eines Fluids zu demonstrieren, wenn es sich durch einen Kompressor ändert..
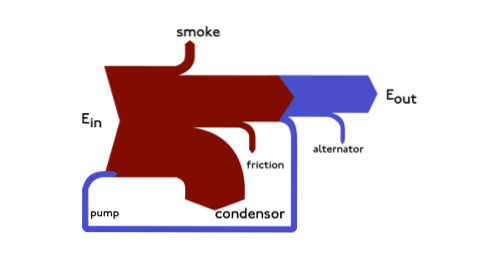
Sankey-Diagramme sind Energiediagramme, in denen die Dicke der Pfeile proportional zur Durchflussmenge angegeben ist. Ein Beispiel kann wie folgt dargestellt werden:
Dieses Diagramm zeigt den gesamten primären Energiefluss in einer Fabrik. Die Dicke der Riemen ist direkt proportional zur Energie der Produktion, Nutzung und Verluste.
Die primären Energiequellen sind Gas, Strom und Kohle / Öl und stellen den Energieeintrag auf der linken Seite des Diagramms dar..
Sie können auch die Energiekosten, den Materialfluss auf regionaler oder nationaler Ebene und die Aufschlüsselung der Kosten eines Artikels oder einer Dienstleistung anzeigen..
Diese Diagramme legen einen visuellen Schwerpunkt auf große Energieübertragungen oder -flüsse innerhalb eines Systems..
Und sie sind sehr nützlich, um dominante Beiträge in einem allgemeinen Fluss zu lokalisieren. Diese Diagramme zeigen häufig konservierte Mengen innerhalb der Grenzen eines definierten Systems..
P-V-Diagramm
Es wird verwendet, um Änderungen zu beschreiben, die den Volumen- und Druckmessungen im System entsprechen. Sie werden üblicherweise in der Thermodynamik, der kardiovaskulären Physiologie und der Atmungsphysiologie verwendet..
P-V-Diagramme wurden ursprünglich als Indikatordiagramme bezeichnet. Sie wurden im 18. Jahrhundert als Werkzeuge entwickelt, um die Effizienz von Dampfmaschinen zu verstehen..
Ein P-V-Diagramm zeigt die Änderung des Drucks P in Bezug auf das Volumen von V eines Prozesses oder von Prozessen.
In der Thermodynamik bilden diese Prozesse einen Zyklus, so dass sich nach Abschluss des Zyklus der Zustand des Systems nicht ändert. wie zum Beispiel in einem Gerät, das zu seinem ursprünglichen Druck und Volumen zurückkehrt.
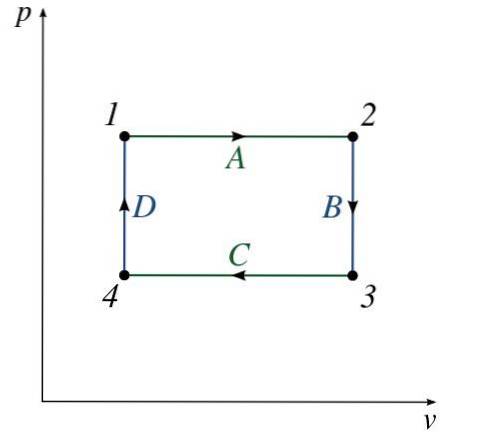
Die Abbildung zeigt die Eigenschaften eines typischen P-V-Diagramms. Eine Reihe von nummerierten Zuständen (von 1 bis 4) kann beobachtet werden.
Der Pfad zwischen den einzelnen Zuständen besteht aus einem Prozess (A bis D), der den Druck oder das Volumen des Systems ändert (ODER beides)..
T-S-Diagramm
Es wird in der Thermodynamik verwendet, um Änderungen der Temperatur und der spezifischen Entropie während eines thermodynamischen Prozesses oder Zyklus zu visualisieren..
Es ist sehr nützlich und ein sehr verbreitetes Werkzeug in der Region, insbesondere da es dabei hilft, die Wärmeübertragung während eines Prozesses zu visualisieren..
Bei reversiblen oder idealen Prozessen ist die Fläche unter der T-S-Kurve eines Prozesses die Wärme, die während dieses Prozesses auf das System übertragen wird..
Ein isentropischer Prozess wird als vertikale Linie in einem T-S-Diagramm dargestellt, während ein isothermer Prozess als horizontale Linie dargestellt wird..
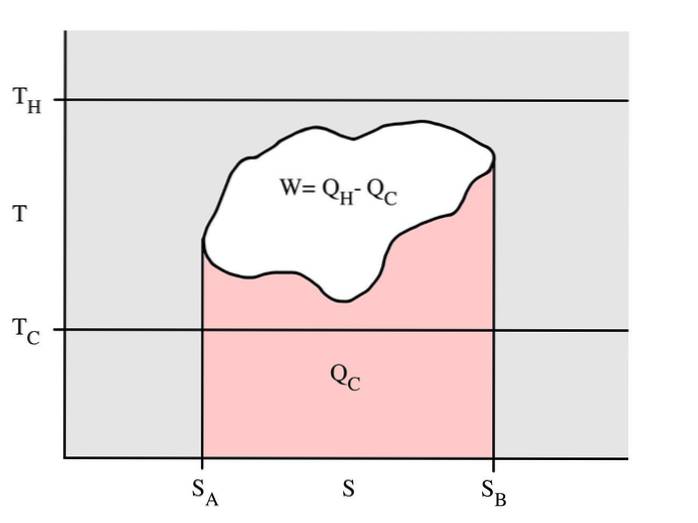
Dieses Beispiel zeigt einen thermodynamischen Zyklus, der bei einer Temperatur des heißen Tanks Tc und einer Temperatur des kalten Tanks Tc stattfindet. In einem reversiblen Prozess ist der rote Bereich Qc die Energiemenge, die zwischen dem System und dem Kältespeicher ausgetauscht wird.
Der leere Bereich W ist die Menge an Energiearbeit, die zwischen dem System und seiner Umgebung ausgetauscht wird. Die zwischen dem heißen Tank ausgetauschte Wärmemenge Qh ist die Summe der beiden.
Wenn sich der Zyklus nach rechts bewegt, bedeutet dies, dass es sich um eine Wärmekraftmaschine handelt, die Arbeit freigibt. Wenn sich der Zyklus in die entgegengesetzte Richtung bewegt, ist es eine Wärmepumpe, die Arbeit erhält und die Wärme Qh vom kalten Tank zum heißen Tank transportiert.
Anorganische Chemie Diagramme
Sie dienen dazu, die mit Atomen verbundenen Molekülorbitale und ihr Energieniveau darzustellen oder zu schematisieren.
Potentialenergiediagramm von Ethan
Die unterschiedlichen Konformationen von Ethan haben nicht die gleiche Energie, da sie eine unterschiedliche elektronische Abstoßung zwischen Wasserstoffatomen aufweisen.
Wenn das Molekül ausgehend von einer bereits gestaffelten Konformation gedreht wird, beginnt der Abstand zwischen den Wasserstoffatomen der jeweiligen Methylgruppen zu schrumpfen. Die potentielle Energie dieses Systems steigt an, bis es eine verdeckte Konformation erreicht.
Die verschiedenen Energiearten zwischen den verschiedenen Konformationen können grafisch dargestellt werden. Im Ethandiagramm wird beobachtet, wie die verdeckten Konformationen die maximale Energie sind; Andererseits wären die Alternativen das Minimum.
In diesem Potentialenergiediagramm geht Ethan von einer verdeckten Konformation aus. Dann drehen sie sich von 60 ° auf 60 °, bis die 360 ° bedeckt sind.
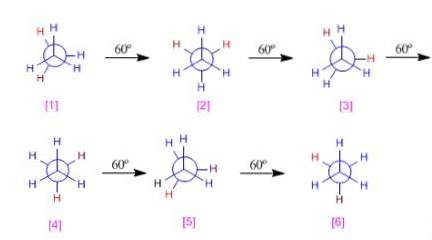
Die verschiedenen Konformationen können nach Energie klassifiziert werden. Zum Beispiel haben die Alternativen 1,3 und 5 die gleiche Energie (0). Andererseits haben die Konformationen 2,4 und 6 infolge der Wasserstoff-Wasserstoff-Sonnenfinsternis mehr Energie
Verweise
- Druckvolumendiagramm. Von wikipedia.org wiederhergestellt
- T-S-Diagramm. Von wikipedia.org wiederhergestellt
- Sankey-Diagramm. Von wikipedia.org wiederhergestellt
- Mögliche Energiediagramme. (2009). Von quimicaorganica.net wiederhergestellt


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.