
Sphingolipideigenschaften, Funktionen, Gruppen, Synthese

Das Sphingolipide Sie stellen eine der drei Hauptfamilien von Lipiden dar, die in biologischen Membranen vorhanden sind. Wie Glycerophospholipide und Sterole sind sie amphipathische Moleküle mit einer hydrophilen polaren Region und einer hydrophoben unpolaren Region..
Sie wurden erstmals 1884 von Johann L. W. Thudichum beschrieben, der drei Sphingolipide (Sphingomyelin, Cerebroside und Cerebrosulfatid) beschrieb, die zu den drei verschiedenen bekannten Klassen gehören: Phosphoesphingolipide, neutrale und saure Glycosphingolipide..
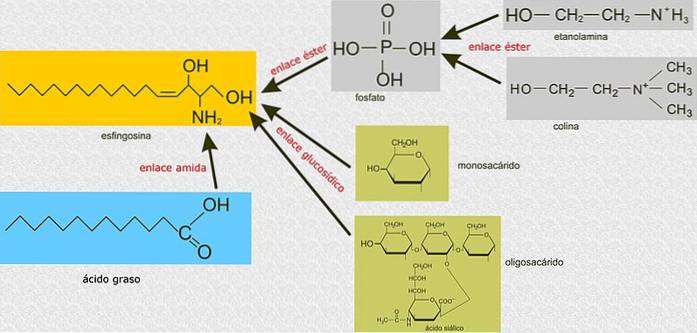
Im Gegensatz zu Glycerophospholipiden bauen Sphingolipide nicht auf einem Glycerin-3-phosphat-Molekül als Hauptgerüst auf, sondern sind Verbindungen, die von Sphingosin abgeleitet sind, einem Aminoalkohol mit einer langen Kohlenwasserstoffkette, die durch eine Amidbindung verbunden ist..
In Bezug auf Komplexität und Diversität sind mindestens 5 verschiedene Basentypen für Sphingolipide bei Säugetieren bekannt. Diese Basen können durch mehr als 20 verschiedene Arten von Fettsäuren mit unterschiedlichen Längen und Sättigungsgraden verbunden werden, zusätzlich zu den mehrfachen Variationen in den polaren Gruppen, die auftreten können..
Biologische Membranen haben etwa 20% Sphingolipide. Diese haben vielfältige und wichtige Funktionen in Zellen, von der strukturellen bis zur Signalübertragung und der Steuerung verschiedener zellulärer Kommunikationsprozesse..
Die Verteilung dieser Moleküle variiert in Abhängigkeit von der Funktion der Organelle, in der sie gefunden werden, aber normalerweise ist die Konzentration an Sphingolipiden in der äußeren Monoschicht der Plasmamembran viel höher als in der inneren Monoschicht und anderen Kompartimenten..
Beim Menschen gibt es mindestens 60 Arten von Sphingolipiden. Viele von ihnen sind wichtige Bestandteile der Membranen von Nervenzellen, während andere unter anderem eine wichtige strukturelle Rolle spielen oder an der Signalübertragung, Erkennung, Zelldifferenzierung, Pathogenese und dem programmierten Zelltod beteiligt sind..
Artikelverzeichnis
- 1 Struktur
- 2 Funktionen
- 3 Funktionen
- 3.1 -Strukturfunktionen
- 3.2 -Signalisierungsfunktionen
- 3.3-Als Rezeptoren in der Membran
- 4 Gruppen von Sphingolipiden
- 4.1 Sphingomyeline
- 4.2 Neutrale Glykolipide oder Glycosphingolipide (kostenlos)
- 4.3 Saure Ganglioside oder Glycosphingolipide
- 5 Synthese
- 5.1 Synthese des Ceramidgerüsts
- 5.2 Bildung spezifischer Sphingolipide
- 6 Stoffwechsel
- 6.1 Regelung
- 7 Referenzen
UNDStruktur
Alle Sphingolipide stammen von einem L-Serin, das mit einer langkettigen Fettsäure kondensiert wird, um die Sphingoidbase zu bilden, die auch als langkettige Base (LCB) bezeichnet wird..
Die häufigsten Basen sind Sphinganin und Sphingosin, die sich nur in Gegenwart einer Doppelbindung voneinander unterscheiden trans zwischen den Kohlenstoffen 4 und 5 der Fettsäure von Sphingosin.
Die Kohlenstoffe 1, 2 und 3 von Sphingosin sind strukturell analog zu den Kohlenstoffen von Glycerin von Glycerophospholipiden. Wenn eine Fettsäure über Amidbindungen an Kohlenstoff 2 von Sphingosin gebunden ist, entsteht ein Ceramid, ein Molekül, das Diacylglycerin sehr ähnlich ist und das einfachste Sphingolipid darstellt.
Die langkettigen Fettsäuren, aus denen die hydrophoben Regionen dieser Lipide bestehen, können sehr unterschiedlich sein. Die Längen variieren von 14 bis 22 Kohlenstoffatomen, die unterschiedliche Sättigungsgrade aufweisen können, üblicherweise zwischen den Kohlenstoffen 4 und 5.
In den Positionen 4 oder 6 können sie Hydroxylgruppen und Doppelbindungen in anderen Positionen oder sogar Verzweigungen wie Methylgruppen aufweisen.
Eigenschaften
Die Fettsäureketten, die durch Amidbindungen an Ceramide gebunden sind, sind üblicherweise gesättigt und tendenziell länger als die in Glycerophospholipiden gefundenen, was für ihre biologische Aktivität entscheidend zu sein scheint..
Eine Besonderheit des Sphingolipid-Gerüsts besteht darin, dass sie bei neutralem pH-Wert eine positive Nettoladung aufweisen können, die unter Lipidmolekülen selten ist..
Die pKa der Aminogruppe ist im Vergleich zu einem einfachen Amin zwischen 7 und 8 niedrig, so dass ein Teil des Moleküls bei physiologischem pH nicht geladen ist, was die "freie" Bewegung dieser zwischen den Doppelschichten erklären könnte.
Die traditionelle Klassifizierung von Sphingolipiden ergibt sich aus den vielfältigen Modifikationen, die das Ceramidmolekül eingehen kann, insbesondere im Hinblick auf die Substitutionen der Gruppen des Polarkopfes.
Eigenschaften
Sphingolipide sind in Tieren, Pflanzen und Pilzen sowie in einigen prokaryotischen Organismen und Viren essentiell..
-Strukturelle Funktionen
Sphingolipide modulieren die physikalischen Eigenschaften von Membranen, einschließlich ihrer Fließfähigkeit, Dicke und Krümmung. Durch die Modulation dieser Eigenschaften haben sie auch direkten Einfluss auf die räumliche Organisation von Membranproteinen..
In den Lipid "Flößen"
In biologischen Membranen können dynamische Mikrodomänen mit geringerer Fließfähigkeit nachgewiesen werden, die aus Cholesterin- und Sphingolipidmolekülen bestehen, die als Lipidflöße bezeichnet werden..
Diese Strukturen kommen auf natürliche Weise vor und sind eng verwandt mit integralen Proteinen, Zelloberflächenrezeptoren und Signalproteinen, Transportern und anderen Proteinen mit Glycosylphosphatidylinositol (GPI) -Ankern..
-Signalisierungsfunktionen
Sie haben Funktionen als Signalmoleküle, die als Second Messenger oder als sekretierte Liganden für Zelloberflächenrezeptoren fungieren..
Als sekundäre Botenstoffe können sie an der Regulation der Calciumhomöostase, des Zellwachstums, der Tumorentstehung und der Unterdrückung der Apoptose beteiligt sein. Darüber hinaus hängt die Aktivität vieler integraler und peripherer Membranproteine von ihrer Assoziation mit Sphingolipiden ab..
Viele Wechselwirkungen zwischen Zellen und der Zelle mit ihrer Umgebung hängen davon ab, ob die verschiedenen polaren Gruppen von Sphingolipiden der Außenseite der Plasmamembran ausgesetzt sind..
Die Bindung von Glycosphingolipiden und Lektinen ist entscheidend für die Assoziation von Myelin mit Axonen, die Adhäsion von Neutrophilen an das Endothel usw..
Nebenprodukte Ihres Stoffwechsels
Die wichtigsten Signal-Sphingolipide sind langkettige Basen oder Sphingosine und Ceramide sowie deren phosphorylierte Derivate wie Sphingosin-1-phosphat.
Die Stoffwechselprodukte vieler Sphingolipide aktivieren oder hemmen mehrere nachgeschaltete Ziele (Proteinkinasen, Phosphoproteinphosphatasen und andere), die komplexe zelluläre Verhaltensweisen wie Wachstum, Differenzierung und Apoptose steuern..
-Als Rezeptoren auf der Membran
Einige Krankheitserreger verwenden Glycosphingolipide als Rezeptoren, um ihren Eintritt in Wirtszellen zu vermitteln oder ihnen Virulenzfaktoren zuzuführen..
Es wurde gezeigt, dass Sphingolipide an mehreren zellulären Ereignissen wie Sekretion, Endozytose, Chemotaxis, Neurotransmission, Angiogenese und Entzündung beteiligt sind.
Sie sind auch am Membranhandel beteiligt und beeinflussen so die Internalisierung von Rezeptoren, die Ordnung, Bewegung und Fusion von sekretorischen Vesikeln als Reaktion auf verschiedene Reize..
Sphingolipidgruppen
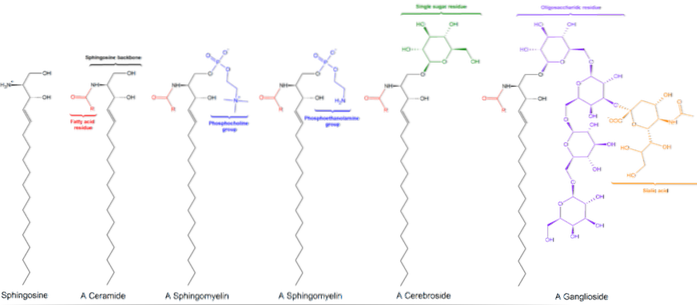
Es gibt drei Unterklassen von Sphingolipiden, die alle von Ceramid abgeleitet sind und sich durch polare Gruppen voneinander unterscheiden, nämlich: Sphingomyeline, Glykolipide und Ganglioside..
Sphingomyeline

Diese enthalten Phosphocholin oder Phosphoethanolamin als polare Kopfgruppe, weshalb sie zusammen mit Glycerophospholipiden als Phospholipide klassifiziert werden. Sie ähneln natürlich Phosphatidylcholinen in dreidimensionaler Struktur und allgemeinen Eigenschaften, da sie an ihren Polköpfen keine Ladung haben..
Sie sind in den Plasmamembranen tierischer Zellen vorhanden und kommen besonders häufig im Myelin vor, einer Hülle, die die Axone einiger Neuronen umgibt und isoliert.
Neutrale Glykolipide oder Glycosphingolipide (kostenlos)
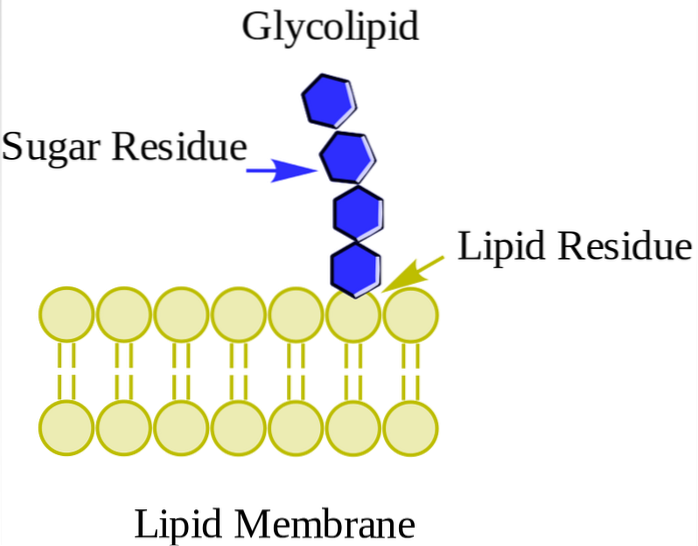
Sie befinden sich hauptsächlich auf der Außenseite der Plasmamembran und haben einen oder mehrere Zucker als polare Kopfgruppe, die direkt an die Hydroxylgruppe von Kohlenstoff 1 des Ceramidanteils gebunden sind. Sie haben keine Phosphatgruppen. Da sie bei pH 7 keine Ladung haben, werden sie als neutrale Glykolipide bezeichnet.
Cerebroside haben ein einzelnes Zuckermolekül, das an Ceramid gebunden ist. Diejenigen, die Galactose enthalten, werden in Plasmamembranen von Nicht-Nerven-Gewebezellen gefunden. Globoside sind Glycosphingolipide mit zwei oder mehr Zuckern, üblicherweise D-Glucose, D-Galactose oder N-Acetyl-D-Galactosamin..
Saure Ganglioside oder Glycosphingolipide
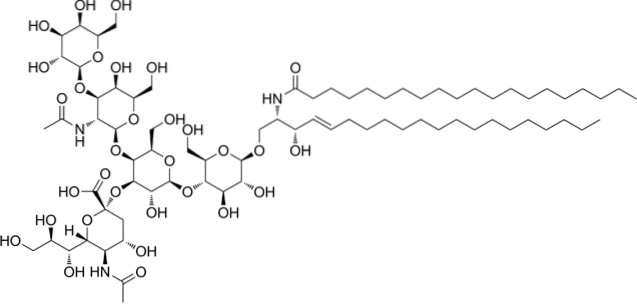
Dies sind die komplexesten Sphingolipide. Sie haben Oligosaccharide als polare Kopfgruppe und einen oder mehrere terminale N-Acetylmuraminsäurereste, auch Sialinsäure genannt. Sialinsäure verleiht Gangliosiden bei pH 7 eine negative Ladung, die sie von neutralen Glycosphingolipiden unterscheidet.
Die Nomenklatur dieser Klasse von Sphingolipiden hängt von der Menge der im Oligosaccharidteil des Polarkopfes vorhandenen Sialinsäurereste ab..
Synthese
Das langkettige Basenmolekül oder Sphingosin wird im endoplasmatischen Retikulum (ER) synthetisiert, und die Addition der polaren Gruppe an den Kopf dieser Lipide erfolgt später im Golgi-Komplex. Bei Säugetieren kann eine gewisse Synthese von Sphingolipiden auch in den Mitochondrien auftreten.
Nach Abschluss ihrer Synthese im Golgi-Komplex werden Sphingolipide durch vesikelvermittelte Mechanismen in andere Zellkompartimente transportiert..
Die Biosynthese von Sphingolipiden besteht aus drei grundlegenden Ereignissen: der Synthese langkettiger Basen, der Biosynthese von Ceramiden durch Vereinigung einer Fettsäure über eine Amidbindung und schließlich der Bildung komplexer Sphingolipide durch Vereinigung der polaren Gruppen auf Kohlenstoff 1 der Sphingoidbasis.
Neben der Synthese de novo, Sphingolipide können auch durch den Umsatz oder das Recycling langkettiger Basen und Ceramide gebildet werden, die den Pool von Sphingolipiden versorgen können.
Synthese des Ceramidgerüsts
Die Biosynthese von Ceramid, dem Rückgrat von Sphingolipiden, beginnt mit der decarboxylierenden Kondensation eines Palmitoyl-CoA-Moleküls und eines L-Serins. Die Reaktion wird durch eine heterodimere Serinpalmitoyltransferase (SPT) katalysiert, die von Pyridoxalphosphat abhängt, und das Produkt ist 3-Ketodihydrosphingosin..
Dieses Enzym wird durch β-Halogen-L-Alanine und L-Cycloserin inhibiert. In Hefe wird es von zwei Genen kodiert, während es bei Säugetieren drei Gene für dieses Enzym gibt. Das aktive Zentrum befindet sich auf der zytoplasmatischen Seite des endoplasmatischen Retikulums.
Die Rolle dieses ersten Enzyms bleibt in allen untersuchten Organismen erhalten. Es gibt jedoch einige Unterschiede zwischen den Taxa, die mit der subzellulären Position des Enzyms zu tun haben: Die von Bakterien ist zytoplasmatisch, die von Hefen, Pflanzen und Tieren befindet sich im endoplasmatischen Retikulum.
3-Ketosphinganin wird anschließend durch NADPH-abhängige 3-Ketosphinganinreduktase reduziert, um Sphinganin zu produzieren. Dihydroceramidsynthase (Sphinganin-N-Acyltransferase) acetyliert dann Sphinganin, um Dihydroceramid herzustellen. Ceramid wird dann durch Dihydroceramid-Desaturase / Reduktase gebildet, die eine Doppelbindung einfügt trans in Position 4-5.
Bei Säugetieren gibt es zahlreiche Isoformen von Ceramidsynthasen, die jeweils eine bestimmte Kette von Fettsäuren an langkettige Basen binden. Daher stellen Ceramidsynthasen und andere Enzyme, Elongasen, die Hauptquelle für die Diversität von Fettsäuren in Sphingolipiden dar..
Spezifische Sphingolipidbildung
Sphingomyelin wird durch Übertragung eines Phosphocholins von Phosphatidylcholin auf Ceramid unter Freisetzung von Diacylglycerin synthetisiert. Die Reaktion bindet die Sphingolipid- und Glycerophospholipid-Signalwege.
Phosphoethanolaminceramid wird aus Phosphatidylethanolamin und Ceramid in einer Reaktion analog zu der der Sphingomyelinsynthese synthetisiert und kann nach seiner Bildung zu Sphingomyelin methyliert werden. Inositphosphat-Ceramide werden durch Umesterung aus Phosphatidylinositol gebildet.
Glycosphingolipide werden hauptsächlich im Golgi-Komplex modifiziert, wo spezifische Glycosyltransferaseenzyme an der Addition von Oligosaccharidketten im hydrophilen Bereich des Ceramidgerüsts beteiligt sind..
Stoffwechsel
Der Abbau von Sphingolipiden erfolgt durch die Enzyme Glucohydrolasen und Sphingomyelinasen, die für die Entfernung der Modifikationen der polaren Gruppen verantwortlich sind. Andererseits regenerieren Ceramidasen langkettige Basen aus Ceramiden.
Ganglioside werden durch eine Reihe von lysosomalen Enzymen abgebaut, die die schrittweise Eliminierung von Zuckereinheiten katalysieren und schließlich ein Ceramid produzieren..
Ein anderer Abbauweg besteht in der Internalisierung von Sphingolipiden in endozytischen Vesikeln, die zur Plasmamembran zurückgeschickt oder zu den Lysosomen transportiert werden, wo sie durch spezifische Säurehydrolasen abgebaut werden..
Nicht alle langkettigen Basen werden recycelt, das endoplasmatische Retikulum hat einen Weg für ihren terminalen Abbau. Dieser Abbau-Mechanismus besteht aus der Phosphorylierung anstelle der Acylierung von LCBs, wodurch Signalmoleküle entstehen, die lösliche Substrate für Lyaseenzyme sein können, die LCBs-Phosphat schneiden, um Acylaldehyde und Phosphoethanolamin zu erzeugen..
Verordnung
Der Metabolismus dieser Lipide wird auf verschiedenen Ebenen reguliert. Eines davon ist das der für die Synthese zuständigen Enzyme, ihre posttranslationalen Modifikationen und ihre allosterischen Mechanismen..
Einige Regulationsmechanismen sind zellspezifisch, entweder um den Moment der Zellentwicklung zu steuern, in dem sie produziert werden, oder als Reaktion auf bestimmte Signale..
Verweise
- Bartke, N. & Hannun, Y. (2009). Bioaktive Sphingolipide: Stoffwechsel und Funktion. Journal of Lipid Research, fünfzig, 19.
- Breslow, D. K. (2013). Sphingolipid-Homöostase im endoplasmatischen Retikulum und darüber hinaus. Cold Spring Harbor Perspektiven in der Biologie, 5(4), a013326.
- Futerman, A. H. & Hannun, Y. A. (2004). Das komplexe Leben einfacher Sphingolipide. EMBO-Berichte, 5(8), 777 & ndash; 782.
- Harrison, P. J., Dunn, T. & Campopiano, D. J. (2018). Sphingolipid-Biosynthese bei Menschen und Mikroben. Naturstoffberichte, 35(9), 921 & ndash; 954.
- Lahiri, S. & Futerman, A. H. (2007). Der Metabolismus und die Funktion von Sphingolipiden und Glycosphingolipiden. Zelluläre und molekulare Biowissenschaften, 64(17), 2270 & ndash; 2284.
- H. Lodish, A. Berk, C. A. Kaiser, M. Krieger, A. Bretscher, H. Ploegh, K. Martin (2003). Molekulare Zellbiologie (5. Aufl.). Freeman, W. H. & Company.
- Luckey, M. (2008). Membranstrukturbiologie: mit biochemischen und biophysikalischen Grundlagen. Cambridge University Press. Abgerufen von www.cambridge.org/9780521856553
- Merrill, A. H. (2011). Sphingolipid- und Glycosphingolipid-Stoffwechselwege im Zeitalter der Sphingolipidomik. Chemische Bewertungen, 111(10), 6387-6422.
- Nelson, D. L. & Cox, M. M. (2009). Lehninger Prinzipien der Biochemie. Omega-Ausgaben (5. Aufl.).
- Vance, J. E. & Vance, D. E. (2008). Biochemie von Lipiden, Lipoproteinen und Membranen. Im New Comprehensive Biochemistry Vol. 36 (4. Aufl.). Elsevier.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.