
Struktur, Eigenschaften, Verwendungen von Tetrachlorkohlenstoff (CCl4)
Das Tetrachlorkohlenstoff Es ist eine farblose Flüssigkeit mit einem leicht süßen Geruch, ähnlich dem Geruch von Äther und Chloroform. Seine chemische Formel lautet CCl4, und es stellt eine kovalente und flüchtige Verbindung dar, deren Dampf eine größere Dichte als Luft hat; Es ist weder ein Stromleiter noch brennbar.
Es kommt in der Atmosphäre, im Flusswasser, im Meer und in Sedimenten auf der Meeresoberfläche vor. Es wird angenommen, dass der in Rotalgen vorhandene Tetrachlorkohlenstoff von demselben Organismus synthetisiert wird.
In der Atmosphäre entsteht es durch die Reaktion von Chlor und Methan. Industriell hergestellter Tetrachlorkohlenstoff gelangt hauptsächlich über die Seeluft-Grenzfläche in den Ozean. Sein atmosphärischer Fluss => ozeanisch wurde auf 1,4 x 10 geschätzt10 g / Jahr, entsprechend 30% des gesamten Tetrachlorkohlenstoffs in der Atmosphäre.
Artikelverzeichnis
- 1 Hauptmerkmale
- 2 Struktur
- 3 Physikalische und chemische Eigenschaften
- 4 Verwendungen
- 4.1 Chemische Herstellung
- 4.2 Herstellung von Kältemitteln
- 4.3 Brandbekämpfung
- 4.4 Reinigung
- 4.5 Chemische Analyse
- 4.6 Infrarotspektroskopie und Kernspinresonanz
- 4.7 Lösungsmittel
- 4.8 Andere Verwendungen
- 5 Toxizität
- 5.1 Hepatotoxische Mechanismen
- 5.2 Toxische Wirkungen auf das Nieren- und Zentralnervensystem
- 5.3 Auswirkungen der Exposition beim Menschen
- 5.4 Toxische Wechselwirkungen
- 6 Intermolekulare Wechselwirkungen
- 7 Referenzen
Haupteigenschaften
Tetrachlorkohlenstoff wird industriell durch thermische Chlorierung von Methan hergestellt, wobei Methan mit Chlorgas bei einer Temperatur zwischen 400 ° C und 430 ° C umgesetzt wird. Während der Reaktion entsteht ein Rohprodukt mit einem Nebenprodukt Salzsäure.
Es wird auch industriell nach dem Schwefelkohlenstoffverfahren hergestellt. Chlor und Schwefelkohlenstoff werden bei einer Temperatur von 90 ° C bis 100 ° C unter Verwendung von Eisen als Katalysator umgesetzt. Dann wird das Rohprodukt fraktioniert, neutralisiert und destilliert.
Die CCl4 Es wurde mehrfach verwendet, unter anderem: Lösungsmittel für Fette, Öle, Lacke usw.; chemische Reinigung von Kleidung; Begasung von Pestiziden, Landwirtschaft und Fungiziden sowie Herstellung von Nylon. Trotz seiner großen Nützlichkeit wurde seine Verwendung aufgrund der hohen Toxizität, die es darstellt, teilweise verworfen..
Beim Menschen erzeugt es toxische Wirkungen auf Haut, Augen und Atemwege. Die schädlichsten Auswirkungen treten jedoch auf die Funktion des Zentralnervensystems, der Leber und der Nieren auf. Nierenschäden sind möglicherweise die häufigste Todesursache, die auf die toxische Wirkung von Tetrachlorkohlenstoff zurückzuführen ist.
Struktur
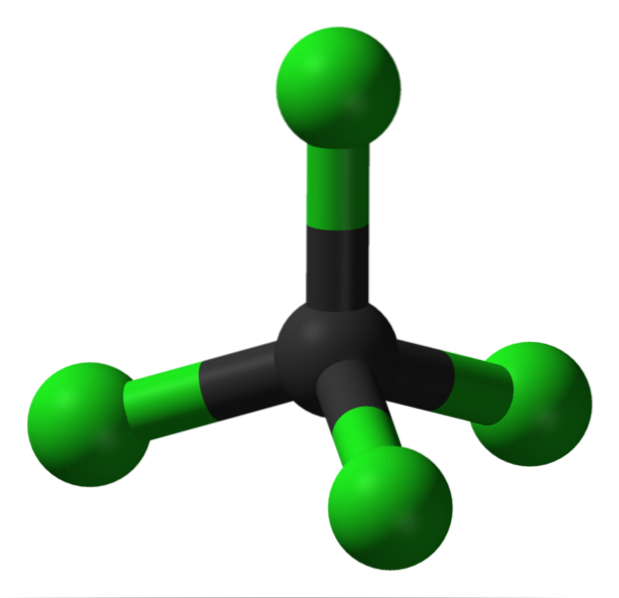
Im Bild sehen Sie die Struktur von Tetrachlorkohlenstoff, der eine tetraedrische Geometrie aufweist. Beachten Sie, dass die Cl-Atome (die grünen Kugeln) im Raum um den Kohlenstoff (schwarze Kugel) herum ausgerichtet sind und ein Tetraeder zeichnen.
Ebenso sollte erwähnt werden, dass die Struktur symmetrisch ist, da alle Eckpunkte des Tetraeders identisch sind; das heißt, egal wie das CCl-Molekül gedreht wird4, es wird immer das gleiche sein. Also, seit dem grünen Tetraeder von CCl4 ist symmetrisch, führt dies zum Fehlen eines permanenten Dipolmoments.
Warum? Denn obwohl die C-Cl-Bindungen aufgrund der größeren Elektronegativität von Cl in Bezug auf C einen polaren Charakter haben, heben sich diese Momente auf vektoriell. Daher ist es eine unpolare chlorierte organische Verbindung..
Kohlenstoff ist in CCl vollständig chloriert4, Dies entspricht einer hohen Oxidation (Kohlenstoff kann maximal vier Bindungen mit Chlor eingehen). Dieses Lösungsmittel neigt nicht dazu, Elektronen zu verlieren, ist aprotisch (enthält keine Wasserstoffatome) und stellt ein kleines Transport- und Speichermittel für Chlor dar..
Physikalische und chemische Eigenschaften
Formel
CCl4
Molekulargewicht
153,81 g / mol.
Aussehen
Es ist eine farblose Flüssigkeit. Kristallisiert in Form von monoklinen Kristallen.
Geruch
Es hat den charakteristischen Geruch, der in anderen chlorierten Lösungsmitteln vorhanden ist. Der Geruch ist aromatisch und etwas süß, ähnlich dem Geruch von Tetrachlorethylen und Chloroform.
Siedepunkt
76,8ºC (170,1ºF) bei 760 mmHg.
Schmelzpunkt
--23ºC (9ºF).
Wasserlöslichkeit
Es ist in Wasser schwer löslich: 1,16 mg / ml bei 25 ° C und 0,8 mg / ml bei 20 ° C. Warum? Weil Wasser, ein hochpolares Molekül, keine Affinität zu Tetrachlorkohlenstoff "fühlt", der unpolar ist..
Löslichkeit in organischen Lösungsmitteln
Tetrachlorkohlenstoff ist aufgrund der Symmetrie seiner Molekülstruktur eine unpolare Verbindung. Daher ist es mit Alkohol, Benzol, Chloroform, Ether, Schwefelkohlenstoff, Petrolether und Naphtha mischbar. Ebenso ist es in Ethanol und Aceton löslich..
Dichte
In flüssigem Zustand: 1,59 g / ml bei 68 ° F und 1,594 g / ml bei 20 ° C..
Im festen Zustand: 1,831 g / ml bei -186 ºC und 1,809 g / ml bei -80 ºC.
Stabilität
Im Allgemeinen inert.
Ätzende Wirkung
Greift einige Formen von Kunststoffen, Gummi und Beschichtungen an.
Zündpunkt
Es gilt als leicht entflammbar und zeigt einen Zündpunkt von weniger als 982 ºC an.
Selbstentzündung
982 ºC (1800 º F; 1255 K).
Wasserdampfdichte
5,32 in Bezug auf Luft, als Referenzwert gleich 1 genommen.
Dampfdruck
91 mmHg bei 68 ° F; 113 mmHg bei 77ºF und 115 mmHg bei 25ºC.
Zersetzung
In Gegenwart von Feuer bildet es Chlorid und Phosgen, eine hochgiftige Verbindung. Ebenso zersetzt es sich unter den gleichen Bedingungen in Chlorwasserstoff und Kohlenmonoxid. In Gegenwart von Wasser bei hohen Temperaturen kann es Salzsäure verursachen.
Viskosität
2,03 x 10-3 Pa s
Geruchsschwelle
21,4 ppm.
Brechungsindex (ηD)
1.4607.
Anwendungen
Chemische Herstellung
-Es greift als Chlorierungsmittel und / oder Lösungsmittel in die Herstellung von organischem Chlor ein. Ebenso greift es als Monomer in die Herstellung von Nylon ein..
-Wirkt als Lösungsmittel bei der Herstellung von Gummizement, Seife und Insektiziden.
-Es wird zur Herstellung des Treibmittels Fluorchlorkohlenwasserstoff verwendet.
-Da es keine CH-Bindungen aufweist, unterliegt Tetrachlorkohlenstoff keinen radikalischen Reaktionen, was es zu einem nützlichen Lösungsmittel für Halogenierungen macht, entweder durch ein elementares Halogen oder durch ein Halogenierungsreagenz wie N-Bromsuccinimid..
Kältemittelherstellung
Es wurde zur Herstellung von Fluorchlorkohlenwasserstoff, Kältemittel R-11 und Trichlorfluormethan, Kältemittel R-12, verwendet. Diese Kältemittel zerstören die Ozonschicht, weshalb empfohlen wurde, ihre Verwendung gemäß den Empfehlungen des Montrealer Protokolls einzustellen..
Feuerunterdrückung
Zu Beginn des 20. Jahrhunderts wurde Tetrachlorkohlenstoff als Feuerlöscher verwendet, basierend auf einer Reihe von Eigenschaften der Verbindung: Es ist flüchtig; sein Dampf ist schwerer als Luft; Es ist kein elektrischer Leiter und nicht sehr entflammbar.
Wenn Tetrachlorkohlenstoff erhitzt wird, verwandelt er sich in einen schweren Dampf, der die Verbrennungsprodukte bedeckt, sie vom in der Luft vorhandenen Sauerstoff isoliert und das Feuer erlischt. Es ist zur Bekämpfung von Öl- und Gerätebränden geeignet.
Bei Temperaturen über 500 ºC kann Tetrachlorkohlenstoff jedoch mit Wasser reagieren und Phosgen, eine toxische Verbindung, verursachen. Daher muss während des Gebrauchs auf die Belüftung geachtet werden. Darüber hinaus kann es explosionsartig mit metallischem Natrium reagieren, und seine Verwendung bei Bränden mit diesem Metall sollte vermieden werden..
Reinigung
Tetrachlorkohlenstoff wird seit langem bei der chemischen Reinigung von Kleidung und anderen Haushaltsmaterialien verwendet. Darüber hinaus wird es als industrieller Metallentfetter verwendet, der sich hervorragend zum Auflösen von Fett und Öl eignet.
Chemische Analyse
Zum Nachweis von Bor, Bromid, Chlorid, Molybdän, Wolfram, Vanadium, Phosphor und Silber.
Infrarotspektroskopie und Kernspinresonanz
-Es wird als Lösungsmittel in der Infrarotspektroskopie verwendet, da Tetrachlorkohlenstoff in Banden> 1600 cm keine signifikante Absorption aufweist-1.
-Es wurde als Lösungsmittel in der Kernspinresonanz verwendet, da es die Technik nicht störte, da es keinen Wasserstoff enthielt (es ist aprotisch). Aufgrund seiner Toxizität und seines geringen Lösungsmittelvermögens wurde Tetrachlorkohlenstoff jedoch durch deuterierte Lösungsmittel ersetzt..
Lösungsmittel
Die Eigenschaft, eine unpolare Verbindung zu sein, ermöglicht die Verwendung von Tetrachlorkohlenstoff als Lösungsmittel für Öle, Fette, Lacke, Lacke, Gummiwachse und Harze. Es kann auch Jod auflösen.
Andere Verwendungen
-Es ist ein wichtiger Bestandteil von Lavalampen, da Tetrachlorkohlenstoff aufgrund seiner Dichte dem Wachs Gewicht verleiht..
-Wird von Briefmarkensammlern verwendet, da Wasserzeichen auf Briefmarken sichtbar sind, ohne Schäden zu verursachen.
-Es wurde als Pestizid- und Fungizidmittel sowie zur Begasung von Getreide verwendet, um Insekten zu beseitigen.
-Beim Zerspanungsprozess wird es als Schmiermittel verwendet.
-Es wurde in der Veterinärmedizin als Anthelminthikum zur Behandlung von Fasziolasen eingesetzt, die durch Fasciola hepatica bei Schafen verursacht werden..
Toxizität
-Tetrachlorkohlenstoff kann über die Atemwege, den Verdauungstrakt, die Augen und die Haut aufgenommen werden. Verschlucken und Einatmen sind sehr gefährlich, da sie das Gehirn, die Leber und die Nieren langfristig schwer schädigen können..
-Hautkontakt führt zu Reizungen und kann langfristig zu Dermatitis führen. Bei Augenkontakt kommt es zu Reizungen.
Hepatotoxische Mechanismen
Die Hauptmechanismen, die Leberschäden verursachen, sind oxidativer Stress und die Veränderung der Kalziumhomöostase.
Oxidativer Stress ist ein Ungleichgewicht zwischen der Produktion reaktiver Sauerstoffspezies und der Fähigkeit des Körpers, in seinen Zellen eine reduzierende Umgebung zu erzeugen, die oxidative Prozesse steuert..
Das Ungleichgewicht im normalen Redoxzustand kann aufgrund der Produktion von Peroxiden und freien Radikalen, die alle Bestandteile der Zellen schädigen, toxische Wirkungen haben..
Tetrachlorkohlenstoff wird unter Bildung freier Radikale metabolisiert: Cl3C.. (Trichlormethylradikal) und Cl3GURREN. (Trichlormethylperoxidradikal). Diese freien Radikale bewirken eine Lipoperoxidation, die die Leber und auch die Lunge schädigt.
Freie Radikale verursachen auch den Abbau der Plasmamembran von Leberzellen. Dies führt zu einer Erhöhung der cytosolischen Calciumkonzentration und zu einer Verringerung des intrazellulären Mechanismus der Calciumsequestrierung..
Erhöhtes intrazelluläres Calcium aktiviert das Enzym Phospholipase A.zwei das wirkt auf Phospholipide der Membran und verstärkt deren Beeinflussung. Zusätzlich gibt es eine Infiltration von Neutrophilen und eine hepatozelluläre Verletzung. Die zelluläre Konzentration von ATP und Glutathion nimmt ab, was zu einer Inaktivierung der Enzyme und zum Zelltod führt.
Toxische Wirkungen auf das Nierensystem und das Zentralnervensystem
Die toxischen Wirkungen von Tetrachlorkohlenstoff manifestieren sich im Nierensystem mit einer Abnahme der Urinproduktion und der Körperansammlung von Wasser. Besonders in der Lunge und eine Erhöhung der Konzentration von Stoffwechselabfällen im Blut. Dies kann zum Tod führen.
Auf der Ebene des Zentralnervensystems ist die axonale Leitung von Nervenimpulsen beteiligt.
Auswirkungen der Exposition beim Menschen
Kurze Dauer
Augen Irritation; Auswirkungen auf Leber, Niere und Zentralnervensystem, die zu Bewusstlosigkeit führen können.
Lange Dauer
Dermatitis und mögliche krebserzeugende Wirkung.
Toxische Wechselwirkungen
Es gibt einen Zusammenhang zwischen vielen Fällen von Tetrachlorkohlenstoffvergiftung und Alkoholkonsum. Übermäßiger Alkoholkonsum führt zu Leberschäden, in einigen Fällen zu Leberzirrhose.
Es wurde beobachtet, dass die Toxizität von Tetrachlorkohlenstoff mit Barbituraten erhöht ist, da sie einige ähnliche toxische Wirkungen haben..
Beispielsweise verringern Barbiturate auf Nierenebene die Urinausscheidung, wobei diese Wirkung von Barbituraten der toxischen Wirkung von Tetrachlorkohlenstoff auf die Nierenfunktion ähnlich ist..
Intermolekulare Wechselwirkungen
Die CCl4 es kann als grüner Tetraeder betrachtet werden. Wie interagierst du mit anderen??
Da es sich um ein unpolares Molekül ohne permanentes Dipolmoment handelt, kann es nicht durch Dipol-Dipol-Kräfte interagieren. Um ihre Moleküle in der Flüssigkeit zusammenzuhalten, müssen die Chloratome (die Eckpunkte der Tetraeder) auf irgendeine Weise miteinander interagieren. und sie tun es dank der Zerstreuungskräfte von London.
Die elektronischen Wolken der Cl-Atome bewegen sich und erzeugen für kurze Momente Bereiche, die reich und arm an Elektronen sind. das heißt, sie erzeugen augenblickliche Dipole.
Die δ-elektronenreiche Zone bewirkt, dass das Cl-Atom eines benachbarten Moleküls polarisiert: Clδ- δ+Cl. Somit können zwei Atome von Cl für eine begrenzte Zeit zusammengehalten werden..
Aber da gibt es Millionen von CCl-Molekülen4, Die Wechselwirkungen werden wirksam genug, um unter normalen Bedingungen eine Flüssigkeit zu bilden.
Darüber hinaus erhöhen die vier kovalent an jedes C gebundenen Cl die Anzahl dieser Wechselwirkungen erheblich; so sehr, dass es bei 76,8 ° C siedet, einem hohen Siedepunkt.
Der Siedepunkt von CCl4 es kann nicht höher sein, da Tetraeder im Vergleich zu anderen unpolaren Verbindungen (wie Xylol, das bei 144 ° C siedet) relativ klein sind.
Verweise
- Hardinger A. Steven. (2017). Illustriertes Glossar der Organischen Chemie: Tetrachlorkohlenstoff. Wiederhergestellt von: chem.ucla.edu
- Alles Siyavula. (s.f.). Intermolekulare und interatomare Kräfte. Wiederhergestellt von: siyavula.com
- Carey F. A. (2006). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Wikipedia. (2018). Tetrachlorkohlenstoff. Wiederhergestellt von: en.wikipedia.org
- PubChem. (2018). Tetrachlorkohlenstoff. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Chemisches Buch. (2017). Tetrachlorkohlenstoff. Wiederhergestellt von: Chemicalbook.com

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.