
Atomradius, wie es gemessen wird, wie es sich ändert und Beispiele
Das Atomradio Es ist ein wichtiger Parameter für die periodischen Eigenschaften der Elemente des Periodensystems. Es hängt direkt mit der Größe der Atome zusammen, denn je größer der Radius, desto größer oder voluminöser sind sie. Ebenso hängt es mit ihren elektronischen Eigenschaften zusammen..
Je mehr Elektronen ein Atom hat, desto größer ist seine Atomgröße und sein Radius. Beide werden durch die Elektronen der Valenzschale definiert, da in Abständen außerhalb ihrer Umlaufbahnen die Wahrscheinlichkeit, ein Elektron zu finden, gegen Null geht. In der Nähe des Kerns tritt das Gegenteil auf: Die Wahrscheinlichkeit, ein Elektron zu finden, steigt.

Das obere Bild zeigt eine Packung Wattebäusche. Beachten Sie, dass jeder von sechs Nachbarn umgeben ist, ohne eine weitere mögliche obere oder untere Reihe zu zählen. Die Art und Weise, wie die Wattebäusche verdichtet werden, bestimmt ihre Größe und damit ihre Radien. genau wie Atome.
Die Elemente interagieren entsprechend ihrer chemischen Natur auf die eine oder andere Weise mit ihren eigenen Atomen. Folglich variiert die Größe des Atomradius in Abhängigkeit von der Art der vorhandenen Bindung und der festen Packung seiner Atome..
Artikelverzeichnis
- 1 Wie wird der Atomradius gemessen??
- 1.1 Bestimmung des Kernabstands
- 1.2 Einheiten
- 2 Wie ändert es sich im Periodensystem??
- 2.1 Über einen Zeitraum
- 2.2 Abstieg durch eine Gruppe
- 2.3 Lanthanoidkontraktion
- 3 Beispiele
- 4 Referenzen
Wie messen Sie den Atomradius??
Im Hauptbild kann es einfach sein, den Durchmesser der Wattebäusche zu messen und dann durch zwei zu teilen. Die Kugel eines Atoms ist jedoch nicht vollständig definiert. Warum? Weil Elektronen in bestimmten Regionen des Weltraums zirkulieren und diffundieren: Orbitale.
Daher kann das Atom als eine Kugel mit unfühlbaren Kanten betrachtet werden, von der man nicht genau sagen kann, wie weit sie enden. Im obigen Bild zeigt beispielsweise der Bereich des Zentrums in der Nähe des Kerns eine intensivere Farbe, während seine Ränder unscharf sind..
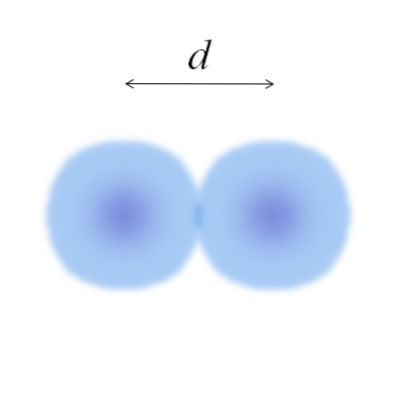
Das Bild zeigt ein zweiatomiges Molekül E.zwei (wie der Clzwei, H.zwei, ODERzwei, usw.). Angenommen, die Atome sind kugelförmige Körper, wenn der Abstand bestimmt würde d das beide Kerne in der kovalenten Bindung trennt, würde es dann ausreichen, sie in zwei Hälften zu teilen (d/ 2) um den Atomradius zu erhalten; genauer gesagt, der kovalente Radius von E nach E.zwei.
Was wäre, wenn E keine kovalenten Bindungen mit sich selbst eingehen würde, sondern ein metallisches Element wäre? Dann d es würde durch die Anzahl der Nachbarn angezeigt, die E in seiner metallischen Struktur umgeben; das heißt, durch die Koordinationszahl (N.C.) des Atoms in der Verpackung (denken Sie an die Wattebäusche im Hauptbild)..
Bestimmung des Kernabstands
Bestimmen d, Dies ist der Kernabstand für zwei Atome in einem Molekül oder einer Verpackung. Physikalische Analysetechniken sind erforderlich.
Eine der am häufigsten verwendeten ist die Röntgenbeugung. Dabei wird ein Lichtstrahl durch einen Kristall bestrahlt und das Beugungsmuster, das sich aus den Wechselwirkungen zwischen Elektronen und elektromagnetischer Strahlung ergibt, untersucht. Abhängig von der Packung können unterschiedliche Beugungsmuster und daher andere Werte von erhalten werden d.
Wenn die Atome im Kristallgitter "dicht" sind, weisen sie unterschiedliche Werte von auf d im Vergleich zu dem, was sie hätten, wenn sie "bequem" wären. Ebenso können diese Kernabstände in ihren Werten schwanken, so dass der Atomradius tatsächlich aus einem Durchschnittswert solcher Messungen besteht..
Wie hängen der Atomradius und die Koordinationszahl zusammen? V. Goldschmidt stellte eine Beziehung zwischen den beiden her, in der für einen N.C. von 12 der relative Wert 1 ist; 0,97 für eine Packung, bei der das Atom N.C gleich 8 hat; 0,96 für eine NC gleich 6; und 0,88 für eine NC von 4.
Einheiten
Aus den Werten für N.C. gleich 12 wurden viele der Tabellen konstruiert, in denen die Atomradien aller Elemente des Periodensystems verglichen werden.
Da nicht alle Elemente solche kompakten Strukturen bilden (N.C. kleiner als 12), wird die V. Goldschmidt-Beziehung verwendet, um ihre Atomradien zu berechnen und sie für dieselbe Packung auszudrücken. Auf diese Weise werden die Messungen der Atomradien standardisiert..
Aber in welchen Einheiten werden sie ausgedrückt? Angenommen d ist von sehr geringer Größe, müssen wir auf die Angström-Einheiten Å (10 ∙ 10) zurückgreifen-10m) oder auch weit verbreitet, das Pikometer (10 ∙ 10-12m).
Wie ändert es sich im Periodensystem??
Über einen Zeitraum
Die für metallische Elemente bestimmten Atomradien werden als metallische Radien bezeichnet, während für nichtmetallische Elemente kovalente Radien (wie Phosphor, P) bezeichnet werden4, oder Schwefel, S.8). Zwischen den beiden Arten von Speichen gibt es jedoch eine deutlichere Unterscheidung als die des Namens.
Im gleichen Zeitraum fügt der Kern von links nach rechts Protonen und Elektronen hinzu, wobei letztere auf dasselbe Energieniveau (Hauptquantenzahl) beschränkt sind. Infolgedessen übt der Kern eine zunehmende effektive Kernladung auf die Valenzelektronen aus, wodurch sich der Atomradius zusammenzieht..
Auf diese Weise neigen nichtmetallische Elemente im gleichen Zeitraum dazu, kleinere atomare (kovalente) Radien als Metalle (metallische Radien) zu haben..
Abstieg durch eine Gruppe
Beim Abstieg durch eine Gruppe werden neue Energieniveaus aktiviert, die es den Elektronen ermöglichen, mehr Platz zu haben. Somit legt die elektronische Wolke größere Entfernungen zurück, ihre unscharfe Peripherie bewegt sich weiter vom Kern weg und daher erweitert sich der Atomradius..
Lanthanidenkontraktion
Die Elektronen in der inneren Hülle helfen dabei, die effektive Kernladung der Valenzelektronen abzuschirmen. Wenn die Orbitale, aus denen die inneren Schichten bestehen, viele „Löcher“ (Knoten) haben, wie dies bei den f-Orbitalen der Fall ist, zieht sich der Kern aufgrund seiner schlechten Abschirmwirkung stark in den Atomradius zusammen..
Diese Tatsache zeigt sich in der Lanthanoidkontraktion in Periode 6 des Periodensystems. Von La nach Hf kommt es zu einer erheblichen Kontraktion des Atomradius infolge der f-Orbitale, die sich beim Durchqueren des f-Blocks „füllen“: die der Lanthanoide und Actinoide.
Ein ähnlicher Effekt kann auch bei den Elementen des Blocks p aus Periode 4 beobachtet werden. Diesmal ist dies das Produkt des schwachen Abschirmeffekts der d-Orbitale, die sich beim Durchlaufen der Übergangsmetallperioden füllen.
Beispiele
Für Periode 2 des Periodensystems sind die Atomradien seiner Elemente:
-Li: 257 Uhr
-Seien Sie: 112 Uhr
-B: 88 Uhr
-C: 77 Uhr
-N: 74 Uhr
-Oder: 66 Uhr
-F: 64 Uhr
Beachten Sie, dass Lithiummetall den größten Atomradius (257 pm) hat, während Fluor, das sich ganz rechts in der Periode befindet, der kleinste von allen ist (64 pm). Der Atomradius nimmt im gleichen Zeitraum von links nach rechts ab, und die aufgeführten Werte zeigen dies.
Wenn Lithium metallische Bindungen bildet, ist sein Radius metallisch; und Fluor, da es kovalente Bindungen (F-F) bildet, ist sein Radius kovalent.
Was ist, wenn Sie die Atomradien in Einheiten von Angström ausdrücken möchten? Teilen Sie sie einfach durch 100: (257/100) = 2,57 Å. Und so weiter mit den restlichen Werten.
Verweise
- Chemie 301. Atomradien. Wiederhergestellt von: ch301.cm.utexas.edu
- CK-12-Stiftung. (28. Juni 2016). Atomradius. Wiederhergestellt von: chem.libretexts.org
- Trends in Atomradien. Entnommen aus: intro.chem.okstate.edu
- Clackamas Community College. (2002). Atomgröße. Wiederhergestellt von: dl.clackamas.edu
- Clark J. (August 2012). Atom- und Ionenradius. Wiederhergestellt von: chemguide.co.uk
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Ausgabe, S. 23, 24, 80, 169). Mc Graw Hill.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.