
Enthalpie der Reaktionsdefinition, Thermochemie, Übungen
Das Reaktionsenthalpie ist eine thermodynamische Funktion, mit der die bei einer chemischen Reaktion gewonnene oder abgegebene Wärme berechnet werden kann, sofern diese Reaktion bei konstantem Druck stattgefunden hat. Es ist definiert als die innere Energie U plus das Produkt des Drucks P durch das Volumen V der Substanzen, die an einer chemischen Reaktion teilnehmen, wie folgt: H = U + P ∙ V.
Daher hat die Enthalpie Energiedimensionen und wird im Internationalen Messsystem in Joule gemessen. Um die Beziehung der Enthalpie mit der bei einer chemischen Reaktion ausgetauschten Wärme zu verstehen, muss man sich an den ersten Hauptsatz der Thermodynamik erinnern, der Folgendes besagt: Q = ΔU + W.

Das erste Gesetz legt fest, dass die in einem thermodynamischen Prozess ausgetauschte Wärme gleich der Variation der inneren Energie der am Prozess beteiligten Substanzen zuzüglich der von diesen Substanzen im Prozess geleisteten Arbeit ist..
In jedem Prozess wird die Arbeit W durch die folgende Beziehung berechnet:
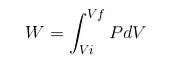
In dem obigen Ausdruck ist Vi das Anfangsvolumen, Vf das Endvolumen und P der Druck. Wenn der Prozess bei konstantem Druck P ausgeführt wird, ergibt sich folgende Arbeit:
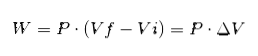
Wobei ΔV die Volumenänderung ist.
Artikelverzeichnis
- 1 Definition
- 2 Beziehung zur Wärme
- 3 Standardenthalpie
- 4 Thermochemie
- 4.1 Die Enthalpie ist eine umfangreiche thermodynamische Größe
- 5 Übungen gelöst
- 5.1 -Übung 1
- 5.2 -Übung 2
- 6 Referenzen
Definition
Chemische Reaktionen sind thermodynamische Prozesse, die im Allgemeinen bei konstantem Druck und sehr häufig bei atmosphärischem Druck ablaufen. Diese Art von thermodynamischen Prozessen wird als "isobar" bezeichnet, da sie bei konstantem Druck ablaufen.
In diesem Fall kann der erste Hauptsatz der Thermodynamik folgendermaßen geschrieben werden:
Qp = ΔU + P ∙ ΔV
Wobei Qp anzeigt, dass die Wärme bei konstantem Druck ausgetauscht wurde. Wenn die Definition der Enthalpie H = U + P ∙ V im vorherigen Ausdruck eingeführt wird, erhalten wir:
Qp = ΔH
Eine positive Enthalpieänderung weist daher auf eine Reaktion hin, die der Umgebung Wärme entzogen hat. Dies ist eine endotherme Reaktion.
Im Gegenteil, wenn die Enthalpieänderung negativ ist, handelt es sich um eine exotherme Reaktion.
Tatsächlich kommt das Wort Enthalpie vom griechischen Wort enthalpien, deren Bedeutung ist "erhitzen".
Enthalpie wird oft auch als Hitze bezeichnet. Es sollte jedoch klar sein, dass es nicht dasselbe ist wie Wärme, sondern dass der Wärmeaustausch während des thermodynamischen Prozesses die Enthalpie verändert.
Beziehung zur Wärme
Im Gegensatz zu Wärme ist die Enthalpie eine Funktion des Zustands. Bei der Berechnung der Enthalpieänderung wird die Differenz zweier Funktionen berechnet, die ausschließlich vom Zustand des Systems abhängen, z. B. interne Energie und Volumen..
ΔH = ΔU + P ∙ ΔV
Da der Druck in der Reaktion konstant bleibt, ist die Enthalpie der Reaktion eine Funktion des Zustands, die nur von der inneren Energie und dem Volumen abhängt..
Bei einer chemischen Reaktion kann die Enthalpie der Reaktanten als die Summe derjenigen von jedem von ihnen definiert werden; und das der Produkte als die Summe der Enthalpie aller Produkte.
Die Enthalpieänderung in einer Reaktion ist die Differenz der Produkte abzüglich der der Reaktanten:
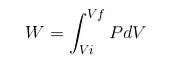
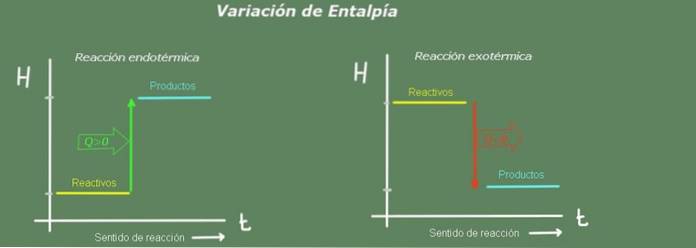
Bei einer endothermen Reaktion ist die Enthalpie der Produkte größer als die der Reaktanten; Das heißt, die Reaktion entzieht der Umgebung Wärme. Im Gegensatz dazu ist bei einer exothermen Reaktion die Enthalpie der Reaktanten größer als die der Produkte, da die Reaktion Wärme an die Umgebung abgibt.
Standardenthalpie
Da die Enthalpieänderung bei einer chemischen Reaktion von Druck und Temperatur abhängen kann, ist es üblich, Standardreaktionsbedingungen zu definieren:
Standardreaktionstemperatur: 25 ° C..
Standardreaktionsdruck: 1 atm = 1 bar.
Die Standardenthalpie wird wie folgt bezeichnet: H °
Thermochemie
In einer thermochemischen Gleichung spielen nicht nur die Reaktanten und Produkte eine Rolle, sondern auch die Enthalpievariation. Unter Enthalpie wird die Reaktion auf die Veränderung verstanden, die während derselben stattfand.
Schauen wir uns als Beispiel die folgenden Reaktionen an:
2 H 2 (Gas) + O 2 (Gas) → 2 H 2 O (Flüssigkeit); ΔH ° = -571,6 kJ (exotherm).
H2 (Gas) + (½) O2 (Gas) → H2O (Flüssigkeit); ΔH ° = -285,8 kJ (exotherm).
2 H 2 O (flüssig) → 2 H 2 (Gas) + O 2 (Gas); ΔH ° = +571,6 kJ (endotherm).
Die Enthalpie ist eine umfangreiche thermodynamische Größe
Wenn die Terme einer chemischen Gleichung mit einem bestimmten Faktor multipliziert oder dividiert werden, wird die Enthalpie mit demselben Faktor multipliziert oder dividiert.
Wenn die Reaktion umgekehrt ist, ist auch das Vorzeichen der Reaktionsenthalpie umgekehrt.
Gelöste Übungen
-Übung 1
Acetylengas C2H2 wird durch die Reaktion von Calciumcarbid CaC2 erhalten, das in granulierter Form mit Wasser bei Umgebungstemperatur und -druck vorliegt..
Als Daten haben wir die Bildungsenthalpien der Reaktanten:
ΔH ° (CaC2) = -59,0 kJ / mol
ΔH ° (H20) = -285,8 kJ / mol
Und die Bildungsenthalpie der Produkte:
ΔH ° (C2H2) = +227,0 kJ / mol
ΔH ° (Ca (OH) 2) = -986,0 kJ / mol
Finden Sie die Standardentropie der Reaktion.
Lösung
Das erste ist, die ausgeglichene chemische Gleichung vorzuschlagen:
CaC2 (s) + 2H20 (l) → Ca (OH) 2 (s) + C2H2 (g)
Und nun die Enthalpien der Reaktanten, Produkte und der Reaktion:
- Reagenzien: -59,0 kJ / mol -2 ≤ 285,8 kJ / mol = -630,6 kJ / mol
- Produkte: -986,0 kJ / mol + 227,0 kJ / mol = -759 kJ / mol
- Reaktion: ΔH ° = -759 kJ / mol - (-630 kJ / mol) = -129 kJ / mol
Es ist eine exotherme Reaktion.
-Übung 2
Wenn 1 Liter Acetylen unter Standardbedingungen verbrannt wird, wie viel Wärme wird abgegeben?
Lösung
Einmal ausgeglichen, sieht die Verbrennungsreaktion von Acetylen folgendermaßen aus:
C 2 H 2 (g) + (5/2) O 2 (g) → 2 CO 2 (g) + H 2 O (l)
Wir brauchen die Bildungsenthalpien der Produkte:
ΔH ° (CO2) = -393,5 kJ / mol
ΔH ° (H 2 O (l)) = -285,8 kJ / mol
Berechnung von Enthalpien
Mit diesen Daten können wir die Enthalpie der Produkte berechnen:
ΔH ° (Produkte) = 2 * (- 393,5 kJ / mol) + (-285,8 kJ / mol) = -1072,8 kJ / mol
Und die Bildungsenthalpie der Reaktanten:
ΔH ° (C2H2) = 227,0 kJ / mol
ΔH ° (O2) = 0,0 kJ / mol
Die Enthalpie der Reaktanten ist:
227,0 kJ / mol + (5/2) * 0,0 = 227,0 kJ / mol
Die molare Reaktionsenthalpie beträgt dann: ΔH ° (Produkte) - ΔH ° (Reaktanten) = -1072,8 kJ / mol - 227,0 kJ / mol = -1299,8 kJ / mol
Verbrennungsenthalpie
Jetzt müssen wir wissen, wie viele Mol Acetylen unter Standardbedingungen ein Liter Acetylen sind. Dazu verwenden wir die Zustandsgleichung eines idealen Gases, aus der wir die Molzahl auflösen.
Molzahl n = P * V / (R * T)
P = 1 atm = 1,013 · 10 & supmin; & sup4; Pa
V = 1 l = 1,0 · 10 & supmin; ³ m³
R = 8,31 J / (mol · K)
T = 25 ° C = 298,15 K.
n = 0,041 mol
Die Verbrennungsenthalpie von 1 Liter Acetylen beträgt 0,041 Mol * (-1299,8 kJ / Mol) = -53,13 kJ
Das negative Vorzeichen zeigt an, dass es sich um eine exotherme Reaktion handelt, die 53,13 kJ = 12,69 kcal ergibt.
Verweise
- Kastanien E. Enthalpie bei chemischen Reaktionen. Wiederhergestellt von: lidiaconlaquimica.wordpress.com
- Thermochemie. Reaktionsenthalpie. Wiederhergestellt von: recursostic.educacion.es
- Thermochemie. Definition der Standardreaktionsenthalpie. Wiederhergestellt von: quimitube.com
- Wikipedia. Standardreaktionsenthalpie. Wiederhergestellt von: wikipedia.com
- Wikipedia. Bildungsenthalpie. Wiederhergestellt von: wikipedia.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.