
Elektrolyse von Wasser Verfahren, Techniken, wofür es ist
Das Elektrolyse von Wasser Es ist die Zersetzung von Wasser in seine elementaren Bestandteile durch Anlegen eines elektrischen Stroms. Wenn Sie fortfahren, Wasserstoff und molekularer Sauerstoff, H.zwei michzwei. Diese beiden Oberflächen sind besser unter dem Namen Elektroden bekannt..
Theoretisch ist das Volumen von H.zwei gebildet muss das doppelte Volumen von O seinzwei. Warum? Da das Wassermolekül ein H / O-Verhältnis von 2 hat, dh zwei H für jeden Sauerstoff. Diese Beziehung wird direkt mit der chemischen Formel H verifiziertzweiO. Viele experimentelle Faktoren beeinflussen jedoch die erhaltenen Volumina.

Wenn die Elektrolyse in in Wasser getauchten Rohren durchgeführt wird (oberes Bild), entspricht die untere Wassersäule Wasserstoff, da eine größere Menge an Gas Druck auf die Oberfläche der Flüssigkeit ausübt. Die Blasen umgeben die Elektroden und steigen nach Überwindung des Dampfdrucks des Wassers auf.
Es ist zu beachten, dass die Röhren so voneinander getrennt sind, dass eine geringe Gasmigration von einer Elektrode zur anderen stattfindet. Bei niedrigen Maßstäben stellt dies kein unmittelbares Risiko dar; aber im industriellen Maßstab ist das gasförmige Gemisch von H.zwei michzwei es ist sehr gefährlich und explosiv.
Aus diesem Grund sind die elektrochemischen Zellen, in denen die Elektrolyse von Wasser durchgeführt wird, sehr teuer; Sie benötigen ein Design und Elemente, die sicherstellen, dass sich Gase niemals vermischen, eine kostengünstige Stromversorgung, hohe Elektrolytkonzentrationen, spezielle Elektroden (Elektrokatalysatoren) und Mechanismen zur Speicherung von H.zwei produziert.
Elektrokatalysatoren repräsentieren Reibung und gleichzeitig Flügel für die Rentabilität der Elektrolyse von Wasser. Einige bestehen aus Edelmetalloxiden wie Platin und Iridium, deren Preise sehr hoch sind. Gerade an diesem Punkt arbeiten Forscher zusammen, um effiziente, stabile und billige Elektroden zu entwickeln..
Der Grund für diese Bemühungen besteht darin, die Bildung von O zu beschleunigenzwei, was bei niedrigeren Geschwindigkeiten im Vergleich zu H auftrittzwei. Dies verlangsamt sich durch die Elektrode, wo das O gebildet wirdzwei es bringt als allgemeine Konsequenz die Anwendung eines Potentials mit sich, das viel größer als nötig ist (Überpotential); Was ist das gleiche, zu einer geringeren Leistung und höheren Kosten.
Artikelverzeichnis
- 1 Elektrolysereaktion
- 1.1 Halbzellreaktionen
- 2 Vorgehensweise
- 3 Techniken
- 3.1 Elektrolyse mit alkalischem Wasser
- 3.2 Elektrolyse mit Polymerelektrolytmembran
- 3.3 Elektrolyse mit festen Oxiden
- 4 Wozu dient die Elektrolyse von Wasser??
- 4.1 Wasserstoffproduktion und ihre Verwendung
- 4.2 Als Debugging-Methode
- 4.3 Als Sauerstoffversorgung
- 5 Heimversuch
- 5.1 Ausgangsvariablen
- 6 Referenzen
Elektrolysereaktion
Die Elektrolyse von Wasser beinhaltet viele komplexe Aspekte. Im Allgemeinen beruht seine Grundlage jedoch auf einer einfachen globalen Reaktion:
2HzweiO (l) => 2Hzwei(g) + O.zwei(G)
Wie aus der Gleichung ersichtlich ist, sind zwei Wassermoleküle beteiligt: eines muss normalerweise reduziert werden oder Elektronen gewinnen, während das andere Elektronen oxidieren oder verlieren muss..
Die H.zwei Es ist ein Produkt der Reduktion von Wasser, da der Gewinn an Elektronen die H-Protonen fördert+ kann kovalent binden und der Sauerstoff wird in OH umgewandelt-. Daher ist die H.zwei tritt an der Kathode auf, die die Elektrode ist, an der die Reduktion stattfindet.
Während der O.zwei kommt von der Oxidation von Wasser, wodurch es die Elektronen verliert, die es ihm ermöglichen, sich an Wasserstoff zu binden, und folglich Protonen H freisetzt+. Das Özwei es wird an der Anode erzeugt, der Elektrode, an der Oxidation auftritt; und im Gegensatz zu der anderen Elektrode ist der pH-Wert um die Anode sauer und nicht basisch.
Halbzellreaktionen
Dies kann mit den folgenden chemischen Gleichungen für Halbzellreaktionen zusammengefasst werden:
2HzweiO + 2e- => H.zwei + 2OH- (Kathode, einfach)
2HzweiO => O.zwei + 4H+ + 4e- (Anode, Säure)
Wasser kann jedoch keine Elektronen mehr verlieren (4e-) von denen das andere Wassermolekül an der Kathode gewinnt (2e-); Daher muss die erste Gleichung mit 2 multipliziert und dann mit der zweiten Gleichung subtrahiert werden, um die Nettogleichung zu erhalten:
2 (2HzweiO + 2e- => H.zwei + 2OH-)
2HzweiO => O.zwei + 4H+ + 4e-
6HzweiO => 2Hzwei + ODERzwei + 4H+ + 4OH-
Aber 4H+ und 4OH- Form 4HzweiOder so entfernen diese vier der sechs Moleküle von H.zweiOder zwei lassen; und das Ergebnis ist die gerade ausgelöste globale Reaktion.
Halbzellreaktionen ändern sich mit pH-Werten, Techniken und haben auch damit verbundene Reduktions- oder Oxidationspotentiale, die bestimmen, wie viel Strom zugeführt werden muss, damit die Elektrolyse von Wasser spontan abläuft..
Prozess
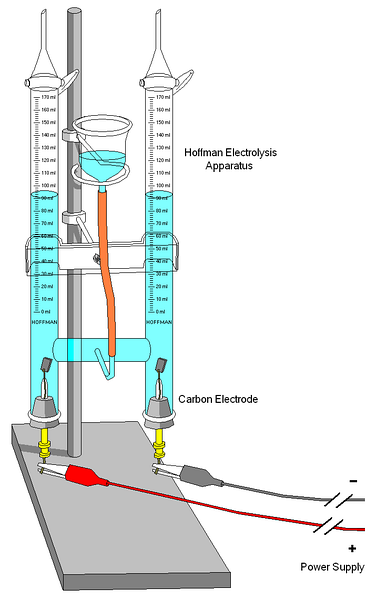
Ein Hoffman-Voltameter ist im obigen Bild gezeigt. Die Zylinder werden durch die mittlere Düse mit Wasser und den ausgewählten Elektrolyten gefüllt. Die Rolle dieser Elektrolyte besteht darin, die Leitfähigkeit des Wassers zu erhöhen, da unter normalen Bedingungen nur sehr wenige H-Ionen vorhanden sind3ODER+ und OH- Produkte seiner Selbstionisation.
Die beiden Elektroden sind normalerweise Platin, obwohl sie im Bild durch Kohlenstoffelektroden ersetzt wurden. Beide sind an eine Batterie angeschlossen, mit der eine Potentialdifferenz (ΔV) angelegt wird, die die Oxidation von Wasser fördert (Bildung von O.zwei).
Die Elektronen wandern durch den gesamten Kreislauf, bis sie die andere Elektrode erreichen, wo das Wasser sie für sich gewinnt und zu H wirdzwei und OH-. Zu diesem Zeitpunkt sind Anode und Kathode bereits definiert, was sich an der Höhe der Wassersäulen unterscheiden lässt; die mit der niedrigsten Höhe entspricht der Kathode, in der das H gebildet wirdzwei.
Oben auf den Zylindern befinden sich Schlüssel, mit denen die erzeugten Gase freigesetzt werden können. Das Vorhandensein von H kann sorgfältig überprüft werdenzwei es reagiert mit einer Flamme, deren Verbrennung gasförmiges Wasser erzeugt.
Techniken
Wasserelektrolysetechniken variieren in Abhängigkeit von der Menge an H.zwei michzwei das wird vorgeschlagen zu generieren. Beide Gase sind sehr gefährlich, wenn sie miteinander vermischt werden, weshalb Elektrolysezellen komplexe Konstruktionen aufweisen, um den Anstieg des Gasdrucks und ihre Diffusion durch das wässrige Medium zu minimieren..
Ebenso variieren die Techniken in Abhängigkeit von der Zelle, dem dem Wasser zugesetzten Elektrolyten und den Elektroden selbst. Andererseits implizieren einige, dass die Reaktion bei höheren Temperaturen durchgeführt wird, wodurch der Stromverbrauch verringert wird, und andere verwenden enorme Drücke, um das H aufrechtzuerhaltenzwei gelagert.
Unter allen Techniken können die folgenden drei erwähnt werden:
Elektrolyse mit alkalischem Wasser
Die Elektrolyse wird mit basischen Lösungen der Alkalimetalle (KOH oder NaOH) durchgeführt. Bei dieser Technik treten folgende Reaktionen auf:
4HzweiO (l) + 4e- => 2Hzwei(g) + 4OH-(ac)
4OH-(ac) => O.zwei(g) + 2HzweiO (l) + 4e-
Wie zu sehen ist, hat Wasser sowohl an der Kathode als auch an der Anode einen basischen pH; und außerdem das OH- wandern zur Anode, wo sie zu O oxidierenzwei.
Elektrolyse mit Polymerelektrolytmembran
Diese Technik verwendet ein festes Polymer, das als durchlässige Membran für H dient+, aber undurchlässig für Gase. Dies sorgt für mehr Sicherheit bei der Elektrolyse..
Die Halbzellreaktionen für diesen Fall sind:
4H+(ac) + 4e- => 2Hzwei(G)
2HzweiO (l) => O.zwei(g) + 4H+(ac) + 4e-
H-Ionen+ wandern von der Anode zur Kathode, wo sie zu H reduziert werdenzwei.
Elektrolyse mit festen Oxiden
Ganz anders als bei anderen Techniken werden hier Oxide als Elektrolyte verwendet, die bei hohen Temperaturen (600-900ºC) als Transportmittel für das Anion O dienenzwei-.
Die Reaktionen sind:
2HzweiO (g) + 4e- => 2Hzwei(g) + 20zwei-
2Ozwei- => O.zwei(g) + 4e-
Beachten Sie, dass diesmal die Oxidanionen O sindzwei-, diejenigen, die zur Anode reisen.
Wofür ist die Elektrolyse von Wasser??
Die Elektrolyse von Wasser erzeugt H.zwei (g) und O.zwei (G). Ungefähr 5% des weltweit erzeugten Wasserstoffgases wird durch Elektrolyse von Wasser hergestellt.
Die H.zwei Es ist ein Nebenprodukt der Elektrolyse von wässrigen NaCl-Lösungen. Die Anwesenheit von Salz erleichtert die Elektrolyse durch Erhöhung der elektrischen Leitfähigkeit des Wassers.
Die Gesamtreaktion, die stattfindet, ist:
2NaCl + 2HzweiO => Clzwei + H.zwei + 2NaOH
Um die enorme Bedeutung dieser Reaktion zu verstehen, werden einige der Verwendungen gasförmiger Produkte erwähnt. Denn letztendlich sind dies diejenigen, die die Entwicklung neuer Methoden vorantreiben, um die Elektrolyse von Wasser effizienter und umweltfreundlicher zu gestalten.
Von allen ist es am erwünschtesten, als Zellen zu fungieren, die die Verwendung brennender fossiler Brennstoffe energetisch ersetzen..
Wasserstoffproduktion und ihre Verwendung
-Bei der Elektrolyse erzeugter Wasserstoff kann in der chemischen Industrie bei Suchtreaktionen, bei Hydrierungsprozessen oder als Reduktionsmittel bei Reduktionsprozessen eingesetzt werden.
-Ebenso ist es bei einigen Aktionen von kommerzieller Bedeutung wesentlich, wie zum Beispiel bei der Herstellung von Salzsäure, Wasserstoffperoxid, Hydroxylaminen usw. Es ist an der Synthese von Ammoniak durch eine katalytische Reaktion mit Stickstoff beteiligt.
-In Kombination mit Sauerstoff entstehen Flammen mit einem hohen Kaloriengehalt bei Temperaturen zwischen 3.000 und 3.500 K. Diese Temperaturen können zum Schneiden und Schweißen in der Metallindustrie, zum Wachstum synthetischer Kristalle, zur Herstellung von Quarz usw. verwendet werden..
-Wasseraufbereitung: Ein zu hoher Nitratgehalt im Wasser kann durch die Eliminierung in Bioreaktoren reduziert werden, in denen Bakterien Wasserstoff als Energiequelle verwenden
-Wasserstoff ist an der Synthese von Kunststoffen, Polyester und Nylon beteiligt. Darüber hinaus ist es Teil der Glasherstellung und erhöht die Verbrennung beim Backen..
-Reagiert mit den Oxiden und Chloriden vieler Metalle, einschließlich Silber, Kupfer, Blei, Wismut und Quecksilber, um reine Metalle herzustellen.
-Zusätzlich wird es als Brennstoff bei der chromatographischen Analyse mit einem Flammenmelder verwendet..
Als Debugging-Methode
Die Elektrolyse von Natriumchloridlösungen wird zur Reinigung des Schwimmbadwassers verwendet. Während der Elektrolyse entsteht Wasserstoff an der Kathode und Chlor (Clzwei) an der Anode. Die Elektrolyse wird in diesem Fall als Salzchlorierer bezeichnet.
Chlor löst sich in Wasser unter Bildung von Hypochlorsäure und Natriumhypochlorit. Hypochlorsäure und Natriumhypochlorit sterilisieren Wasser.
Als Sauerstoffversorgung
Die Elektrolyse von Wasser wird auch zur Erzeugung von Sauerstoff auf der Internationalen Raumstation verwendet, die dazu dient, eine Sauerstoffatmosphäre in der Station aufrechtzuerhalten..
Wasserstoff kann in einer Brennstoffzelle verwendet werden, einer Methode zum Speichern von Energie und zum Verwenden des in der Zelle erzeugten Wassers für den Verbrauch durch Astronauten.
Heimversuch
Wasserelektrolyseexperimente wurden im Labormaßstab mit Hoffman-Voltmetern oder einer anderen Anordnung durchgeführt, die es ermöglicht, alle notwendigen Elemente einer elektrochemischen Zelle aufzunehmen..
Von allen möglichen Baugruppen und Geräten kann der einfachste ein großer transparenter Wasserbehälter sein, der als Zelle dient. Darüber hinaus muss jede metallische oder elektrisch leitende Oberfläche vorhanden sein, um als Elektroden zu fungieren. eine für die Kathode und die andere für die Anode.
Zu diesem Zweck können auch Stifte mit scharfen Graphitspitzen an beiden Enden nützlich sein. Und schließlich eine kleine Batterie und einige Kabel, die sie mit den improvisierten Elektroden verbinden..
Wenn es nicht in einem transparenten Behälter durchgeführt wird, wäre die Bildung von Gasblasen nicht erwünscht..
Home-Variablen
Obwohl die Elektrolyse von Wasser ein Thema ist, das viele interessante und hoffnungsvolle Aspekte für diejenigen enthält, die nach alternativen Energiequellen suchen, kann das Heimversuch für Kinder und andere Zuschauer langweilig sein..
Daher kann eine ausreichende Spannung angelegt werden, um die Bildung von H zu erzeugenzwei michzwei bestimmte Variablen abwechseln und die Änderungen notieren.
Die erste davon ist die Variation des pH-Werts des Wassers, wobei entweder Essig zum Ansäuern des Wassers oder Na verwendet wirdzweiCO3 um es leicht zu begründen. Die Anzahl der beobachteten Blasen muss sich ändern.
Zusätzlich könnte das gleiche Experiment mit heißem und kaltem Wasser wiederholt werden. Auf diese Weise würde dann der Einfluss der Temperatur auf die Reaktion berücksichtigt..
Um die Datenerfassung etwas weniger farblos zu machen, kann eine sehr verdünnte Lösung von Purpurkohlsaft verwendet werden. Dieser Saft ist ein Säure-Base-Indikator natürlichen Ursprungs.
Wenn Sie es mit den eingesetzten Elektroden in den Behälter geben, wird festgestellt, dass das Wasser an der Anode rosa (sauer) wird, während an der Kathode die Farbe gelb (basisch) ist..
Verweise
- Wikipedia. (2018). Elektrolyse von Wasser. Wiederhergestellt von: en.wikipedia.org
- Chaplin M. (16. November 2018). Elektrolyse von Wasser. Wasserstruktur und Wissenschaft. Wiederhergestellt von: 1.lsbu.ac.uk.
- Energieeffizienz und erneuerbare Energien. (s.f.). Wasserstoffproduktion: Elektrolyse. Wiederhergestellt von: energy.gov
- Phys.org. (14. Februar 2018). Hocheffizienter, kostengünstiger Katalysator für die Wasserelektrolyse. Wiederhergestellt von: phys.org
- Chemie LibreTexts. (18. Juni 2015). Elektrolyse von Wasser. Wiederhergestellt von: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. und S. Lewis N. (2016). Prinzipien und Implementierungen von Elektrolysesystemen zur Wasserspaltung. Die Royal Society of Chemistry.
- Regenten der University of Minnesota. (2018). Elektrolyse von Wasser 2. University of Minnesota. Wiederhergestellt von: chem.umn.edu


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.