
Chlorsäure (HClO3) Formel, Eigenschaften, Verwendungen
Das Chlorsäure ist eine anorganische Verbindung mit der Formel HClO3, zusammengesetzt aus einer Oxidsäure, bei der Chlor eine Oxidationsstufe von +5 mit einer Struktur aufweist, die analog zu Bromsäure oder Iodsäure ist. Es ist eine starke Säure, die Wasserstoff an einen Akzeptor oder eine Bronsted-Base abgeben kann..
Säure wurde erstmals im 17. Jahrhundert von Johann Rudolf Glauber aus Karlstadt am Main entdeckt, in dem er Natriumchlorid und Schwefelsäure zur Herstellung von Natriumsulfat im Mannheimer Verfahren verwendete und dabei für den Menschen schädliches Chloridgas aus Wasserstoff freisetzte.
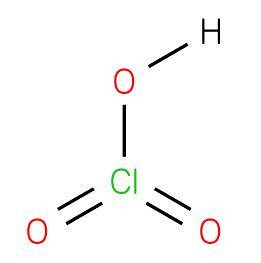
Die Verbindung wird mit Bariumchlorat (Barytchlorat) mit Schwefelsäure erhalten, um in Wasser unlösliches Bariumsulfat (Jacob Green, 1829) gemäß der folgenden Reaktion herzustellen:
Ba (ClO3)zwei + H.zweiSW4 → 2HClO3 + Baso4
Ein anderes Verfahren zum Erhalten ist das Erhitzen von Hypochlorsäure, um Chlorsäure und Chlorwasserstoff gemäß der Reaktion zu erhalten:
3HClO → HClO3 + 2HCl
Chlorsäure (HClO3) ist ein starkes Oxidationsmittel, da es auf die Oxidationsstufen +3, +1 und -1 reduziert werden kann. Es wird zur Herstellung von Chloratsalzen verwendet.
Es zersetzt sich in Konzentrationen von mehr als 30%. Es zersetzt sich auch beim Erhitzen. Aus diesem Grund muss es ständig kalt gehalten werden und alle zur Handhabung verwendeten Gläser müssen zuvor gekühlt werden..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 1.1 Selbstreaktiv
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften
Chlorsäure existiert nur in Lösung. Es ist eine farblose Flüssigkeit ohne charakteristisches Aroma (Nationales Zentrum für Biotechnologie-Informationen, 2017). Ihr Aussehen ist in Abbildung 2 dargestellt.

Die Verbindung hat ein Molekulargewicht von 84,459 g / mol und eine Dichte von 1 g / ml bei etwa 25 ° C. Es hat einen Siedepunkt von mehr als 100 ° C (CHLORSÄURE, S.F.) und eine Wasserlöslichkeit von 40 g pro 100 ml dieses Lösungsmittels bei 25 ° C (Royal Society of Chemistry, 2015)..
Chlorsäure beschleunigt das Verbrennen brennbarer Materialien und kann sich bei Kontakt am meisten entzünden. Die Verbindung ist ätzend gegenüber Metallen und Geweben.
Selbstreaktiv
- Chlorsäurekonzentrationen über 40% werden abgebaut.
- Antimonsulfid- und konzentrierte Chlorsäurelösungen reagieren mit Glühlampen.
- Arsensulfid- und konzentrierte Chlorsäurelösungen reagieren mit Glühlampen.
- Reagiert heftig und explodiert sogar mit anderen Metallsulfiden, d. H. Kupfersulfid.
- Bei Kontakt mit oxidierbaren Materialien, einschließlich Ammoniak, können Reaktionen extrem heftig sein..
- Das Filterpapier leuchtet nach dem Eintauchen in Salzsäure auf.
- Die Explosionen wurden durch Gemische von Chlorsäurelösung mit Metallen wie Antimon, Wismut und Eisen registriert. Dies ist auf die Bildung explosiver Verbindungen einschließlich Wasserstoff zurückzuführen (CHLORSÄURE, 2016)..
Reaktivität und Gefahren
Chlorsäure ist eine instabile Verbindung. Als starke Säure ist sie bei Hautkontakt (ätzend und reizend), bei Augenkontakt (reizend) und bei Verschlucken äußerst gefährlich. Auch beim Einatmen sehr gefährlich.
Schwere Überbelichtung kann zu Lungenschäden, Erstickung, Bewusstlosigkeit oder zum Tod führen. Eine längere Exposition kann zu Hautverbrennungen und Geschwüren führen.
Eine Überbelichtung durch Einatmen kann zu Reizungen der Atemwege führen. Eine Entzündung des Auges ist durch Rötung, Bewässerung und Juckreiz gekennzeichnet. Eine Entzündung der Haut ist durch Juckreiz, Peeling, Rötung und gelegentliche Blasenbildung gekennzeichnet.
Die Substanz ist giftig für Nieren, Lunge und Schleimhäute. Wiederholter oder längerer Kontakt mit dem Stoff kann diese Organe schädigen..
Überprüfen Sie bei Kontakt mit den Augen, ob Sie Kontaktlinsen tragen, und entfernen Sie diese sofort. Die Augen sollten mindestens 15 Minuten lang mit fließendem Wasser gespült werden, wobei die Augenlider offen bleiben sollten. Kaltes Wasser kann verwendet werden. Augensalbe sollte nicht verwendet werden.
Wenn die Chemikalie mit Kleidung in Kontakt kommt, entfernen Sie sie so schnell wie möglich, um Ihre eigenen Hände und Ihren Körper zu schützen. Stellen Sie das Opfer unter eine Sicherheitsdusche.
Wenn sich die Chemikalie auf der exponierten Haut des Opfers ansammelt, z. B. auf den Händen, wird die kontaminierte Haut vorsichtig und sorgfältig mit fließendem Wasser und nicht abrasiver Seife gewaschen..
Die Säure kann auch mit verdünntem Natriumhydroxid oder einer schwachen Base wie Backpulver neutralisiert werden. Bei anhaltender Reizung einen Arzt aufsuchen. Waschen Sie die kontaminierte Kleidung, bevor Sie sie erneut verwenden.
Bei starkem Hautkontakt sollte diese mit einer Desinfektionsseife gewaschen und die kontaminierte Haut mit einer antibakteriellen Creme abgedeckt werden..
Im Falle einer Inhalation sollte das Opfer in einem gut belüfteten Bereich ruhen dürfen. Wenn die Inhalation schwerwiegend ist, sollte das Opfer so bald wie möglich an einen sicheren Ort evakuiert werden..
Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte. Wenn das Opfer Schwierigkeiten beim Atmen hat, sollte Sauerstoff verabreicht werden. Wenn das Opfer nicht atmet, wird eine Mund-zu-Mund-Beatmung durchgeführt.
Berücksichtigen Sie immer, dass es für die Person, die Hilfe bei der Mund-zu-Mund-Beatmung leistet, gefährlich sein kann, wenn das eingeatmete Material giftig, infektiös oder ätzend ist.
Bei Verschlucken kein Erbrechen herbeiführen. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatten. Wenn das Opfer nicht atmet, führen Sie eine Mund-zu-Mund-Beatmung durch. Suchen Sie in jedem Fall sofort einen Arzt auf..
Anwendungen
Chlorsäure wird hauptsächlich zur Bildung von Chloratsalzen wie Natrium-, Calcium-, Magnesium-, Strontium-, Blei-, Kupfer- und Silberchlorat sowie Protochlor- und Quecksilberperchlorat verwendet, die unter Verwendung von Chlorsäure als Reagenz hergestellt werden..
Der stabile Vorläufer von Chlordioxid wird bei der elektrochemischen Herstellung von hochreinem Ammoniumperchlorat verwendet (Dotson, 1993)..
Die Hauptproduktion von Chlorsäure begann während der industriellen Revolution in Europa und wurde zur Herstellung von Vinylchlorid für PVC-Rohre verwendet.
Eine weitere Verwendung für Säure sind zahlreiche kleinere Anwendungen, einschließlich Haushaltsreinigung, Herstellung von Gelatine und anderen Lebensmittelzusatzstoffen, Entkalkung und Lederverarbeitung (Chlorsäure, S.F.).
Verweise
- Chlorsäure. (2016). Aus Cameochemikalien gewonnen: Cameochemicals.noaa.gov.
- Chlorsäure. (S.F.). Von weebly wiederhergestellt: http://chloricacid.weebly.com/
- Chlorsäure. (S.F.). Aus dem Chemiebuch wiederhergestellt: Chemicalbook.com.
- Dotson, R. (1993). Ein neuartiges elektrochemisches Verfahren zur Herstellung von Ammoniumperchlorat. Journal of Applied Electrochemistry Volume 23, Ausgabe 9,, 897-904. link.springer.com.
- EMBL-EBI. (2014, 28. Juli). Chlorsäure. Von ebi.ac.uk wiederhergestellt: ebi.ac.uk..
- Jacob Green, E. T. (1829). Ein Lehrbuch der chemischen Philosophie . Philadelphia: Russell & Martien.
- Nationales Zentrum für Biotechnologie-Informationen… (2017, 15. April). PubChem Compound Database; CID = 19654. Aus pubchem wiederhergestellt: .pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Chlorsäure. Von chemspider wiederhergestellt: chemspider.com.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.