
Dibenzalaceton-Eigenschaften, Reaktionsmechanismus, Verwendung, Risiken
Das Dibenzalaceton (dba) ist eine organische Verbindung, deren Summenformel C ist17H.14O. Es ist ein gelblicher Feststoff, der je nach Reinheit als Kristalle auftreten kann. Es wird in Sonnenschutzmitteln und metallorganischen Synthesen verwendet, bei denen Palladium als Katalysator verwendet wird.
Obwohl seine Synthese ein relativ einfacher Prozess ist, der in Lehrlabors zur Erklärung der Aldolkondensation häufig vorkommt, ist sein Mechanismus etwas umfangreich und es müssen mehrere Faktoren berücksichtigt werden. Der verwendete Benzaldehyd, der mit Aceton kondensiert, muss frisch destilliert werden, um eine geringe Oxidation bei Kontakt mit Luft zu gewährleisten..

Ebenso wird ein basisches Ethanol-Wasser-Medium verwendet, um die Reagenzien zu solubilisieren und gleichzeitig die endgültige Ausfällung von Dibenzalaceton, einer hydrophoben und unlöslichen Verbindung, zu fördern. Bisher ist nicht bekannt, welche negativen Auswirkungen Dibenzalaceton auf den Körper oder die Umwelt haben kann, außer dass es sich um eine reizende Substanz handelt.
Artikelverzeichnis
- 1 Eigenschaften
- 1.1 Aussehen
- 1,2 Molmasse
- 1.3 Isomere
- 1.4 Schmelzpunkt
- 1.5 Löslichkeit in Wasser
- 1.6 Struktur
- 2 Reaktionsmechanismus von Dibenzalaceton
- 3 Synthese
- 3.1 Reagenzien
- 3.2 Vorgehensweise
- 3.3 Rekristallisation
- 4 Verwendungen
- 5 Risiken
- 6 Referenzen
Eigenschaften
Aussehen
Staubiger oder kristallin aussehender gelblicher Feststoff.
Molmasse
234,29 g / mol
Isomere
Dibenzalaceton kommt als drei geometrische Isomere vor: trans-trans, trans-cis und cis-cis. Das trans-trans-Isomer ist das stabilste von allen und daher dasjenige, das während der Synthese am meisten produziert wird.
Schmelzpunkt
110-111 ° C. Dieser Bereich variiert in Abhängigkeit vom Reinheitsgrad des synthetisierten Feststoffs..
Wasserlöslichkeit
Unlöslich.
Struktur
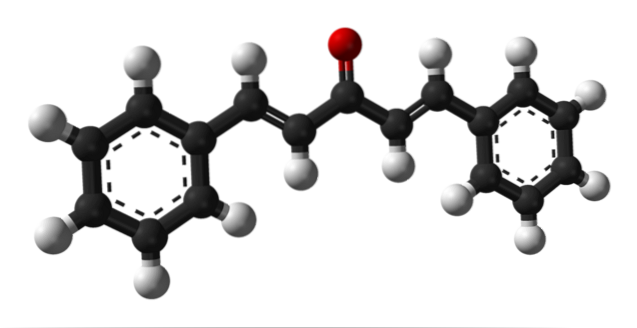
Das obere Bild zeigt das Molekül des trans-trans-Dibenzalaceton-Isomers, dargestellt durch ein Modell von Kugeln und Balken. In der Mitte haben wir die Carbonylgruppe und an ihren Seiten einige Doppelbindungen und zwei aromatische Benzolringe.
Dibenzalaceton ist im Wesentlichen unpolar und hydrophob, da seine gesamte Struktur praktisch aus Kohlenstoff- und Wasserstoffatomen besteht. Die Carbonylgruppe gibt ihm nur ein kleines Dipolmoment.
Die Struktur kann mit der eines Blattes verglichen werden, da alle seine Kohlenstoffatome eine sp-Hybridisierung aufweisenzwei;; Daher ruhen sie auf derselben Ebene.
Photonen des Lichts interagieren mit dem π-konjugierten System von Dibenzalaceton; insbesondere solche der UV-Strahlung, die absorbiert werden, um delokalisierte Elektronen anzuregen. Diese Eigenschaft macht Dibenzalaceton zu einem hervorragenden Absorber für ultraviolettes Licht..
Reaktionsmechanismus von Dibenzalaceton
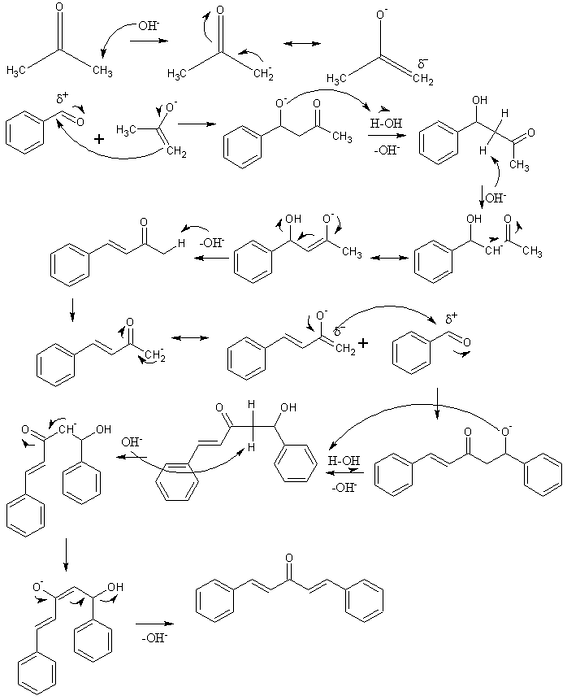
Im oberen Bild haben wir den Mechanismus der Aldolkondensation zwischen Benzaldehyd und Aceton dargestellt, um so Dibenzalaceton zu erzeugen; speziell sein trans-trans-Isomer.
Die Reaktion beginnt mit Aceton in einem basischen Medium. Das OH- deprotoniert ein saures Proton einer seiner beiden Methylgruppen, -CH3, Anlass zu einem Enolat: CH3C (O) CHzwei-, welches seine negative Ladung durch Resonanz delokalisiert (erste Reihe des Bildes).
Dieses Enolat wirkt dann als nukleophiles Mittel: Es greift die Carbonylgruppe eines Benzaldehydmoleküls an. Durch den Einbau in Benzaldehyd entsteht ein Alkoxid, das, da es sehr basisch ist, ein Wassermolekül deprotoniert und zu einem Aldol wird (zweite Reihe). Das Aldol oder β-Hydroxyketon ist dadurch gekennzeichnet, dass es die Gruppen C = O und OH aufweist.
Das basische Medium dehydratisiert dieses Aldol und es bildet sich eine Doppelbindung in seiner Struktur, die Benzylidenaceton erzeugt (dritte Reihe). Als nächstes wird die OH- es deprotoniert auch einen seiner sauren Wasserstoffatome und wiederholt einen weiteren nukleophilen Angriff auf ein zweites Benzaldehydmolekül. Diesmal erfolgt der Angriff langsamer (vierte Reihe).
Das gebildete Produkt deprotoniert ein anderes Wassermolekül und wird erneut dehydratisiert, um die OH-Gruppe zu eliminieren und eine zweite Doppelbindung (fünfte und sechste Reihe) herzustellen. So und schließlich wird Dibenzalaceton hergestellt.
Synthese
Reagenzien
Die Reagenzien zur Durchführung der Synthese von Dibenzalaceton sind die folgenden:
- 95% Ethanol.
- Frisch destillierter Benzaldehyd aus Bittermandelöl.
- NaOH als basischer Katalysator in destilliertem Wasser.
Die zu verwendenden Mengen hängen davon ab, wie viel Dibenzalaceton synthetisiert werden soll. Es wird jedoch angestrebt, dass ein Überschuss an Benzaldehyd vorliegt, da ein Teil davon zu Benzoesäure oxidiert wird. Es ist auch garantiert, dass die Reaktion weniger Zeit in Anspruch nimmt und dass das unerwünschte Benzylidenaceton in geringerem Maße produziert wird..
Ethanol wirkt als Lösungsmittel für Benzaldehyd, da es sich sonst nicht im basischen NaOH-Medium löst.
Prozess
Mischen Sie in einem großen Becherglas das Ethanol mit dem Benzaldehyd. Dann wird das basische NaOH-Medium unter konstantem Magnetrühren zugegeben. In diesem Schritt tritt die Cannizzaro-Reaktion in geringerem Maße auf; das heißt, zwei Benzaldehydmoleküle disproportionieren in eines von Benzylalkohol und das andere von Benzoesäure, was leicht an seinem charakteristischen süßen Geruch zu erkennen ist.
Schließlich wird das Aceton zugegeben und die Lösung eine halbe Stunde gewartet, bis sie eine trübe und gelb-orange Farbe annimmt. Dibenzalaceton fällt aufgrund von Wasser aus, so dass ein beträchtliches Volumen Wasser hinzugefügt wird, um seine vollständige Ausfällung zu fördern..
Das Dibenzalaceton wird unter Vakuum filtriert und sein gelblicher Feststoff mehrmals mit destilliertem Wasser gewaschen..
Rekristallisation

Zur Reinigung des Dibenzalacetons wird 95% Ethanol oder heißes Ethylacetat verwendet, so dass bei jeder Wiederholung der Rekristallisation Kristalle von größerer Reinheit erhalten werden. Somit wird das anfängliche gelbliche Pulver in kleine gelbe Dibenzalacetonkristalle umgewandelt..
Anwendungen
Dibenzalaceton ist eine Verbindung, die nicht viele Verwendungszwecke hat. Aufgrund seiner Fähigkeit, ultraviolettes Licht zu absorbieren, wird es zur Formulierung von Sonnenschutzmitteln oder anderen Produkten verwendet, die das Auftreten von UV-Strahlen, sei es Beschichtungen oder Farben, verringern sollen..
Andererseits wird Dibenzalaceton in den metallorganischen Synthesen von Palladium verwendet. Es wirkt als Bindemittel, das an die Palladiummetallatome Pd koordiniert0, unter Bildung des Tris (dibenzylidenaceton) dipalladiumkomplexes (0).
Diese metallorganische Verbindung liefert Pd-Atome0 in verschiedenen organischen Synthesen verhält es sich also wie ein homogener Katalysator, da es sich in vielen organischen Lösungsmitteln löst.
Außerdem kann Dibenzalaceton als Bindemittel leicht durch andere organische Bindemittel ersetzt werden, wodurch sich die metallorganischen Synthesen von Palladium schnell entwickeln können..
Risiken
In Bezug auf die Risiken sind nicht viele Informationen verfügbar, die über die möglichen Auswirkungen von Dibenzalaceton auf die Gesundheit oder die Umwelt berichten. In seinem reinen Zustand ist es ein fester Reizstoff durch Verschlucken, Atmen oder durch direkten Kontakt mit den Augen oder der Haut..
Es ist jedoch anscheinend nicht reizend genug, dass es nicht Teil von Sonnenschutzformulierungen sein kann. Andererseits ist seine Konzentration in Wasser, da es in Wasser so unlöslich ist, vernachlässigbar und präsentiert sich als feste Verunreinigung. In diesem Sinne ist nicht bekannt, wie schädlich die dadurch verursachte Trübung für die Meeresfauna oder den Meeresboden ist..
Bis zum Beweis des Gegenteils wird Dibenzalaceton als relativ sichere Verbindung angesehen, da seine geringe Reaktivität kein Grund für ein Risiko oder größere Vorsichtsmaßnahmen ist..
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. (10. Auflage). Wiley plus.
- Wikipedia. (2020). Dibenzylidenaceton. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2020). Dibenzylidenaceton. PubChem Database., CID = 640180. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Organische Synthesen. (2020). Dibenzalaceton. Wiederhergestellt von: orgsyn.org
- Dibenzalaceton durch Aldolkondensation. Wiederhergestellt von: web.mnstate.edu


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.