
Struktur, Eigenschaften, Verwendungen und Risiken von Triethylamin
Das Triethylamin ist eine organische Verbindung, genauer gesagt ein aliphatisches Amin, dessen chemische Formel N (CH) istzweiCH3)3 oder NEt3. Wie andere flüssige Amine hat es einen ähnlichen Geruch wie Ammoniak, das mit Fisch gemischt ist. Seine Dämpfe machen es mühsam und gefährlich, mit dieser Substanz ohne Dunstabzugshaube oder geeignete Kleidung umzugehen.
Zusätzlich zu ihren jeweiligen Formeln wird diese Verbindung häufig als TEA abgekürzt; Dies kann jedoch zu Verwechslungen mit anderen Aminen wie Triethanolamin, N (EtOH) führen.3, oder Tetraethylammonium, ein quaternäres Amin, NEt4+.

Aus seinem Skelett (oberes Bild) kann man sagen, dass Triethylamin Ammoniak ziemlich ähnlich ist; während der zweite drei Wasserstoffatome hat, NH3, Die erste hat drei Ethylgruppen, N (CHzweiCH3)3. Seine Synthese beginnt mit der Behandlung von flüssigem Ammoniak mit Ethanol, wobei eine Alkylierung auftritt.
Das Netz3 kann mit HCl ein hygroskopisches Salz bilden: Triethylaminhydrochlorid, NEt3· HCl. Darüber hinaus ist es als homogener Katalysator an der Synthese von Estern und Amiden beteiligt und damit ein notwendiges Lösungsmittel in organischen Labors..
Zusammen mit anderen Reagenzien ermöglicht es auch die Oxidation von primären und sekundären Alkoholen zu Aldehyden bzw. Ketonen. Wie Ammoniak ist es eine Base und kann daher durch Neutralisationsreaktionen organische Salze bilden.
Artikelverzeichnis
- 1 Struktur von Triethylamin
- 2 Eigenschaften
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Siedepunkt
- 2.4 Schmelzpunkt
- 2.5 Dichte
- 2.6 Löslichkeit
- 2.7 Dampfdichte
- 2.8 Dampfdruck
- 2.9 Henry-Konstante
- 2.10 Flammpunkt
- 2.11 Selbstentzündungstemperatur
- 2.12 Wärmekapazität
- 2.13 Verbrennungswärme
- 2.14 Verdampfungswärme
- 2.15 Oberflächenspannung
- 2.16 Brechungsindex
- 2.17 Viskosität
- 2.18 Basizitätskonstante
- 2.19 Basizität
- 3 Verwendungen
- 3.1 Polymere
- 3.2 Chromatographie
- 3.3 Kommerzielle Produkte
- 4 Risiken
- 5 Referenzen
Struktur von Triethylamin
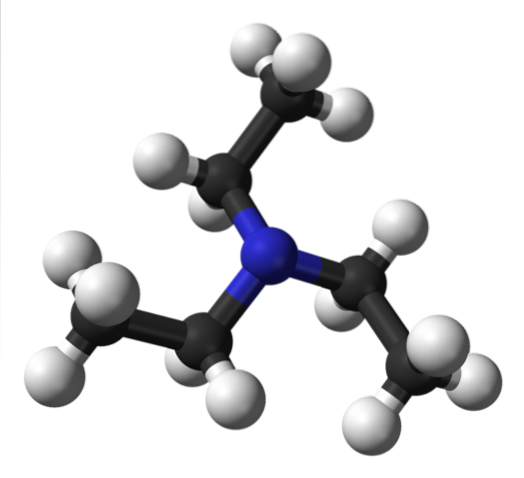
Das obere Bild zeigt die Struktur von Triethylamin mit einem Modell von Kugeln und Balken. Im Zentrum des Moleküls befindet sich das Stickstoffatom, dargestellt durch eine bläuliche Kugel; und damit verbunden sind die drei Ethylgruppen, wie kleine Zweige schwarzer und weißer Kugeln.
Obwohl sie mit bloßem Auge nicht sichtbar sind, befindet sich am Stickstoffatom ein Paar ungeteilter Elektronen. Diese zwei Elektronen und die drei -CH-GruppenzweiCH3 sie erfahren elektronische Abstoßungen; Andererseits tragen sie dazu bei, das Dipolmoment des Moleküls zu definieren.
Ein solches Dipolmoment ist jedoch geringer als das von beispielsweise Diethylamin, NHEtzwei;; und ebenso fehlt ihm jede Möglichkeit, Wasserstoffbrückenbindungen zu bilden.
Dies liegt daran, dass in Triethylamin keine NH-Bindung vorhanden ist und folglich niedrigere Schmelz- und Siedepunkte im Vergleich zu anderen Aminen beobachtet werden, die auf diese Weise interagieren..
Obwohl es ein leichtes Dipolmoment gibt, können die Dispersionskräfte zwischen den Ethylgruppen der NEt-Moleküle nicht ausgeschlossen werden.3 Nachbarn. Wenn man diesen Effekt addiert, ist es gerechtfertigt, warum Triethylamin, obwohl es flüchtig ist, dank seiner relativ großen Molekülmasse bei etwa 89ºC siedet..
Eigenschaften
Aussehen
Farblose Flüssigkeit mit unangenehmem Ammoniak und Fischgeruch.
Molmasse
101,193 g / mol.
Siedepunkt
89ºC.
Schmelzpunkt
-115 ° C. Beachten Sie, wie schwach die intermolekularen Kräfte sind, die die Triethylaminmoleküle in ihrem Feststoff binden.
Dichte
0,7255 g / ml.
Löslichkeit
Es ist relativ wasserlöslich, 5,5 g / 100 g bei 20 ° C. Unter 18,7 ºC ist es laut Pubchem sogar damit mischbar.
Zusätzlich zum "Auskommen" mit Wasser ist es auch in Aceton, Benzol, Ethanol, Ether und Paraffin löslich..
Wasserdampfdichte
3,49 im Luftverhältnis.
Dampfdruck
57,07 mmHg bei 25 ° C..
Henrys Konstante
66 μmol / Pa kg.
Zündpunkt
-15ºC.
Selbstentzündungstemperatur
312ºC.
Wärmekapazität
216,43 kJ / mol.
Verbrennungswärme
10.248 cal / g.
Verdampfungswärme
34,84 kJ / mol.
Oberflächenspannung
20,22 N / m bei 25 ° C..
Brechungsindex
1.400 bei 20ºC.
Viskosität
0,347 mPa · s bei 25 ° C..
Basizitätskonstante
Triethylamin hat einen pKb von 3,25.
Basizität
Die Basizität für dieses Amin kann durch die folgende chemische Gleichung ausgedrückt werden:
Netz3 + HA <=> NHEt3+ + ZU-
Wo HA eine schwach saure Spezies ist. Das NHEt-Paar3+ZU- macht das aus, was zu einem tertiären Ammoniumsalz wird.
Konjugierte Säure NHEt3+ ist stabiler als Ammonium, NH4+, weil die drei Ethylgruppen einen Teil ihrer Elektronendichte abgeben, um die positive Ladung am Stickstoffatom zu verringern; Daher ist Triethylamin basischer als Ammoniak (aber weniger basisch als OH-).
Anwendungen

Die Basizität, in diesem Fall die Nucleophilie von Triethylamin, wird verwendet, um die Synthese von Ester und Amiden aus einem gemeinsamen Substrat zu katalysieren: einem Acylchlorid, RCOCl (oberes Bild).
Hier greift das freie Elektronenpaar aus Stickstoff die Carbonylgruppe an und bildet ein Zwischenprodukt; welches nacheinander von einem Alkohol oder einem Amin angegriffen wird, um einen Ester bzw. ein Amid zu bilden.
In der ersten Reihe des Bildes wird der Mechanismus sichtbar gemacht, dem die Reaktion zur Herstellung des Esters folgt, während die zweite Reihe dem Amid entspricht. Es ist zu beachten, dass bei beiden Reaktionen Triethylaminhydrochlorid, NEt, erzeugt wird3HCl, aus der der Katalysator gewonnen wird, um einen weiteren Zyklus zu starten.
Polymere
Die Nucleophilie von Triethylamin wird auch verwendet, um bestimmte Polymere zu addieren, sie zu härten und ihnen größere Massen zu verleihen. Beispielsweise ist es Teil der Synthese von Polycarbonatharzen, Polyurethanschäumen und Epoxidharzen.
Chromatographie
Aufgrund seiner entfernten Amphiphilität und Flüchtigkeit können die abgeleiteten Salze als Reagenzien für die Ionenaustauschchromatographie verwendet werden. Eine andere implizite Verwendung von Triethylamin besteht darin, dass verschiedene tertiäre Aminsalze daraus erhalten werden können, wie Triethylaminbicarbonat, NHEt3HCO3 (oder TEAB).
Kommerzielle Produkte
Es wurde als Zusatzstoff bei der Formulierung von Zigaretten und Tabak, Lebensmittelkonservierungsmitteln, Bodenreinigern, Aromen, Pestiziden, Farbstoffen usw. verwendet..
Risiken
Triethylamin-Dämpfe sind nicht nur unangenehm, sondern auch gefährlich, da sie Nase, Rachen und Lunge reizen und zu Lungenödemen oder Bronchitis führen können. Da sie dichter und schwerer als Luft sind, bleiben sie bodenbündig und bewegen sich zu möglichen Wärmequellen, um später zu explodieren..
Behälter dieser Flüssigkeit sollten so weit wie möglich vom Feuer entfernt sein, da sie eine unmittelbare Explosionsgefahr darstellen..
Darüber hinaus sollte der Kontakt mit Spezies oder Reagenzien wie Alkalimetallen, Trichloressigsäure, Nitraten, Salpetersäure (da sie Nitrosoamine, krebserzeugende Verbindungen bilden würde), starken Säuren, Peroxiden und Permanganaten vermieden werden..
Es sollte Aluminium, Kupfer, Zink oder deren Legierungen nicht berühren, da es diese angreifen kann.
In Bezug auf körperlichen Kontakt kann es bei akuter Exposition zu Allergien und Hautausschlägen kommen. Zusätzlich zur Lunge kann es Leber und Nieren betreffen. Und in Bezug auf Augenkontakt kommt es zu Reizungen, die sogar die Augen schädigen können, wenn sie nicht rechtzeitig behandelt oder gereinigt werden..
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Wikipedia. (2019). Triethylamin. Wiederhergestellt von: en.wikipedia.org
- Merck. (2019). Triethylamin. Wiederhergestellt von: sigmaaldrich.com
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Triethylamin. PubChem-Datenbank. CID = 8471. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Toxikologisches Datennetz. (s.f.). Triethylamin. Wiederhergestellt von: toxnet.nlm.nih.gov
- Gesundheitsministerium von New Jersey. (2010). Triethylamin. Wiederhergestellt von: nj.gov



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.