
Struktur, Eigenschaften, Verwendungen und Risiken von Isoamylalkohol
Das Isoamylalkohol ist eine organische Verbindung mit der Formel (CH3)zweiCHCHzweiCHzweiOH. Chemisch gesehen ist es ein verzweigter primärer Alkohol und bildet eines der Isomere von Pentanol, Amylalkohole genannt (C.5H.12ODER).
Wie viele Alkohole mit niedrigem Molekulargewicht ist es bei Raumtemperatur eine farblose Flüssigkeit. Dies ermöglicht und erleichtert seine Verwendung als Lösungsmittel für verschiedene Anwendungen; Dies gilt umso mehr, wenn es nach der Entsorgung nicht zu viele negative Auswirkungen auf das Ökosystem hat.
Obwohl es ein Zwischenmaterial bei der Synthese von Amylacetat zur Herstellung künstlicher Bananendüfte ist, ist sein eigener Geruch unangenehm und dem von Birnen ähnlich..
Es dient nicht nur als Lösungsmittel für mehrere biologische Substanzen und als Zwischenprodukt bei der Synthese anderer Acetate, sondern verringert auch die Oberflächenspannung bestimmter industrieller Formulierungen und verhindert die Bildung von Schäumen. Daher wird es in mikroemulgierten Systemen verwendet.
In Bezug auf seinen natürlichen Ursprung wurde Isoamylalkohol in den Pheromonen von Hornissen und in schwarzen Trüffeln gefunden, einer Pilzart in Südosteuropa.
Artikelverzeichnis
- 1 Struktur von Isoamylalkohol
- 1.1 Intermolekulare Wechselwirkungen
- 2 Eigenschaften
- 2.1 Aussehen
- 2.2 Geruch und Geschmack
- 2,3 Molmasse
- 2.4 Dichte
- 2,5 Dampfdichte
- 2.6 Dampfdruck
- 2.7 Siedepunkt
- 2.8 Schmelzpunkt
- 2.9 Flammpunkt
- 2.10 Selbstentzündungstemperatur
- 2.11 Löslichkeit
- 2.12 Viskosität
- 2.13 Oberflächenspannung
- 2.14 Brechungsindex
- 2.15 Wärmekapazität
- 3 Verwendungen
- 3.1 Rohmaterial
- 3.2 Düfte
- 3.3 Entschäumer
- 3.4 Extraktionen
- 4 Risiken
- 4.1 Lagerung und Reaktivität
- 4.2 Gesundheit
- 5 Referenzen
Struktur von Isoamylalkohol
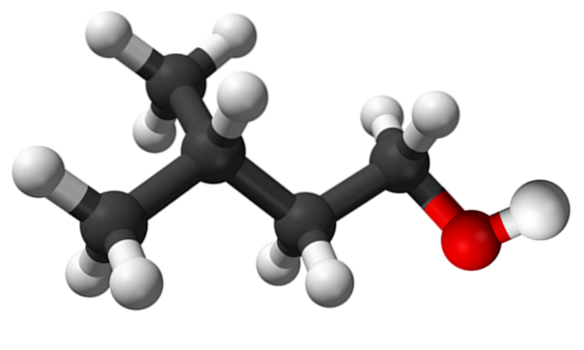
Das obere Bild zeigt das Isoamylalkoholmolekül, das mit einem Kugel- und Balkenmodell dargestellt ist. Rechts davon entspricht die rötliche Kugel dem für alle Alkohole charakteristischen Sauerstoffatom der OH-Gruppe; während auf der linken Seite das Kohlenstoffgerüst mit einer Methylgruppe, CH, ist3, Verzweigungsstruktur.
Aus molekularer Sicht ist diese Verbindung dynamisch, da sie Atome mit sp-Hybridisierungen aufweist3, Erleichterung der Rotation Ihrer Links; solange es nicht dazu führt, dass OH und CH in den Schatten stellen3.
Erwähnenswert ist auch seine amphiphile Eigenschaft: Es hat ein unpolares oder hydrophobes Ende, das aus der Kette (CH) besteht3)zweiCHCHzweiCHzwei-, und einen polaren oder hydrophilen Kopf, die OH-Gruppe. Diese Definition von zwei spezifischen Bereichen unterschiedlicher Polarität macht diesen Alkohol zu einem Tensid; und damit seine Anwendung für Mikroemulsionen.
Intermolekulare Wechselwirkungen
In Gegenwart der OH-Gruppe zeigt das Isoamylalkoholmolekül ein permanentes Dipolmoment. Folglich gelingt es den Dipol-Dipol-Kräften, ihre Moleküle zu binden, was für die physikalischen und messbaren Eigenschaften der Flüssigkeit sowie für ihren Geruch verantwortlich ist..
Obwohl die Verzweigung der Hauptketten die effektiven Wechselwirkungen zwischen den Molekülen verringert, kompensieren die Wasserstoffbrückenbindungen in diesem Alkohol diese Abnahme, wodurch die Flüssigkeit bei 131 ° C siedet, einer Temperatur über dem Siedepunkt von Wasser..
Nicht dasselbe passiert mit seinem Feststoff oder "Eis", das bei -117 ° C schmilzt, was darauf hinweist, dass seine intermolekularen Wechselwirkungen nicht stark genug sind, um seine Moleküle in Ordnung zu halten; vor allem wenn die CH-Gruppe3 Diese Verzweigung der Hauptkette verhindert einen besseren Kontakt zwischen den Molekülen.
Eigenschaften
Aussehen
Farblose Flüssigkeit.
Riechen und schmecken
Gibt einen unangenehmen birnenartigen Geruch ab und hat einen scharfen Geschmack.
Molmasse
88,148 g / mol.
Dichte
0,8104 g / ml bei 20 ° C. Es ist daher weniger dicht als Wasser.
Wasserdampfdichte
Es ist 3,04-mal dichter als Luft.
Dampfdruck
2,37 mmHg bei 25 ° C..
Siedepunkt
131,1 ° C..
Schmelzpunkt
-117,2 ° C..
Zündpunkt
43 ° C (geschlossene Tasse).
Selbstentzündungstemperatur
340 ° C..
Löslichkeit
Es ist relativ wasserlöslich: 28 g / l. Dies liegt daran, dass die hochpolaren Moleküle in Wasser keine besondere Affinität zur Kohlenstoffkette von Isoamylalkohol aufweisen. Wenn sie gemischt würden, würden zwei Phasen beobachtet: eine niedrigere, die Wasser entspricht, und eine höhere, die von Isoamylalkohol..
Im Gegensatz dazu ist es in weniger polaren Lösungsmitteln wie Aceton, Diethylether, Chloroform, Ethanol oder Eisessig viel löslicher; und sogar in Petrolether.
Viskosität
3,738 cP bei 25 ° C..
Oberflächenspannung
24,77 Dyn / cm bei 15 ° C..
Brechungsindex
1,4075 bei 20 ° C..
Wärmekapazität
2.382 kJ / gK.
Anwendungen
Rohstoff
Andere Ester, Thiophen und Arzneimittel wie Amylnitrit, Validol (Menthylisovalerat), Bromisoval (Bromovalerylharnstoff), Corvalol (ein Baldrian-Beruhigungsmittel) und Barbamil (Amobarbital) können aus Isoamylalkohol synthetisiert werden..
Düfte
Neben der Synthese von Amylacetat mit Bananenaroma werden auch andere Fruchtdüfte wie Aprikose, Orangen, Pflaumen, Kirschen und Malz daraus gewonnen. Daher ist es ein notwendiger Alkohol bei der Herstellung vieler essbarer oder kosmetischer Produkte..
Entschäumer
Durch die Verringerung der Oberflächenspannung wird die Verwendung in mikroemulgierten Systemen gefördert. Praktisch wird die beschleunigte Bildung von Blasen vermieden und deren Größe verringert, bis sie brechen.
Es hilft auch, die Grenzfläche zwischen der wässrigen und der organischen Phase während der Extraktion besser zu definieren. Beispielsweise wird der Extraktormischung Phenol-Chloroform in einem Verhältnis von 25: 24: 1 zugesetzt. Diese Technik ist für die DNA-Extraktion vorgesehen.
Extraktionen
Isoamylalkohol ermöglicht es auch, Fette oder Öle aus verschiedenen Proben zu extrahieren, beispielsweise aus Milch. Ebenso löst es Paraffinwachs, Tinten, Gummi, Lacke und Celluloseester.
Weiter mit den Extraktionen ist es möglich, Phosphorsäure aus Nitratlösungen von Eisenphosphatmineralien zu erhalten..
Risiken
Lagerung und Reaktivität
Wie jede Flüssigkeit, die Gerüche abgibt, kann sie eine unmittelbare Brandgefahr darstellen, wenn der Ort, an dem sie gelagert wird, ihre Temperatur zu hoch erhöht, noch mehr, wenn bereits eine Wärmequelle vorhanden ist.
Unter diesen Bedingungen wirkt es einfach als Brennstoff, der die Flammen befeuert und sogar seinen Behälter explodiert. Beim Brennen werden Dämpfe freigesetzt, die die Gesundheit beeinträchtigen und Ersticken verursachen können.
Andere Ursachen, aus denen Isoamylalkohol Feuer fängt, sind das Mischen oder das Reagieren mit Substanzen wie Perchloraten, Peroxiden, Brom, Fluor, Metallhydriden, starken Säuren, aliphatischen Aminen usw..
Gesundheit
Bei Hautkontakt kann es reizen und austrocknen. Die Symptome sind jedoch schwerwiegender, wenn sie zu lange eingeatmet werden (Husten, Verbrennungen an Nase, Rachen und Lunge) oder wenn sie verschluckt werden (Kopfschmerzen, Übelkeit, Durchfall, Erbrechen, Schwindel und Bewusstlosigkeit)..
Und schließlich, wenn es in die Augen gelangt, reizt es sie und kann sie sogar irreversibel beschädigen. Glücklicherweise kann es aufgrund seines Geruchs nach "alkoholischer Birne" im Falle eines Lecks oder einer Verschüttung erkannt werden. Darüber hinaus ist es eine Verbindung, die mit Respekt behandelt werden muss.
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Wikipedia. (2019). Isoamylalkohol. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Isoamylalkohol. PubChem-Datenbank. CID = 31260. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Zhang Yu & Muhammed Mamoun. (17. September 2008). Extraktion von Phosphorsäure aus Nitratlösungen mit Isoamylalkohol. Lösungsmittelextraktion und Ionenaustausch Band 6, 1988 - Ausgabe 6. doi.org/10.1080/07366298808917973
- Gesundheitsministerium von New Jersey. (2008). Isoamylalkohol. [PDF]. Wiederhergestellt von: nj.gov
- Kat Chem. (2019). Isoamylalkohol. Wiederhergestellt von: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Isoamylalkohol. Wiederhergestellt von: chemoxy.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.