
Moeller Diagramm dessen, woraus es besteht und Übungen gelöst
Das Moeller-Diagramm o Die Regenmethode ist eine grafische und mnemonische Methode, um Madelungs Regel zu lernen. das heißt, wie man die Elektronenkonfiguration eines Elements schreibt. Es ist dadurch gekennzeichnet, dass Diagonalen durch die Säulen der Orbitale gezogen werden und der Pfeilrichtung gefolgt wird, wobei die entsprechende Reihenfolge für ein Atom festgelegt wird.
In einigen Teilen der Welt ist das Moeller-Diagramm auch als das bekannt Regenmethode. Dadurch wird eine Ordnung in der Füllung der Orbitale definiert, die auch durch die drei Quantenzahlen definiert sind n, l Y. ml.
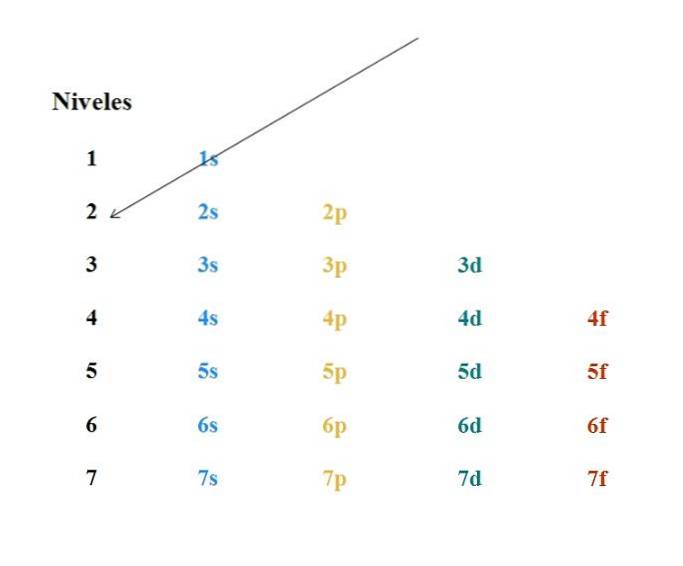
Ein einfaches Moeller-Diagramm ist im obigen Bild dargestellt. Jede Spalte entspricht unterschiedlichen Orbitalen: s, p, d und f mit ihren jeweiligen Energieniveaus. Der erste Pfeil zeigt an, dass die Füllung eines Atoms mit dem 1s-Orbital beginnen muss.
Daher muss der nächste Pfeil vom 2s-Orbital und dann vom 2p bis zum 3s-Orbital beginnen. Auf diese Weise, als wäre es ein Regen, die Orbitale und die Anzahl der Elektronen, die sie enthalten (4l+zwei).
Das Moeller-Diagramm ist eine Einführung für diejenigen, die Elektronenkonfigurationen untersuchen..
Artikelverzeichnis
- 1 Was ist das Moeller-Diagramm??
- 1.1 Madelungs Regel
- 1.2 Schritte folgen
- 2 Gelöste Übungen
- 2.1 Beryllium
- 2.2 Phosphor
- 2.3 Zirkonium
- 2.4 Iridium
- 2.5 Ausnahmen vom Moeller-Diagramm und der Madelung-Regel
- 3 Referenzen
Was ist das Moeller-Diagramm??
Madelungs Regel
Da das Moeller-Diagramm aus einer grafischen Darstellung der Madelungschen Regel besteht, muss bekannt sein, wie diese funktioniert. Das Füllen der Orbitale muss den folgenden zwei Regeln entsprechen:
-Die Orbitale mit den niedrigsten Werten von n+l werden zuerst gefüllt, sein n die Hauptquantenzahl und l der Drehimpuls der Umlaufbahn. Zum Beispiel entspricht das 3D-Orbital n= 3 und l= 2 also, n+l= 3 + 2 = 5; Mittlerweile entspricht das 4s-Orbital n= 4 und l= 0 und n+l= 4 + 0 = 4. Aus dem Obigen wird festgestellt, dass die Elektronen zuerst das 4s-Orbital füllen als das 3d-Orbital.
-Wenn zwei Orbitale den gleichen Wert von haben n+l, Die Elektronen besetzen zuerst die mit dem niedrigsten Wert von n. Zum Beispiel hat das 3D-Orbital einen Wert von n+l= 5, wie das 4p-Orbital (4 + 1 = 5); aber da hat 3d den kleinsten wert von n, wird früher als 4p füllen.
Aus den beiden vorhergehenden Beobachtungen kann die folgende Reihenfolge der Füllung der Orbitale erreicht werden: 1s 2s 2p 3s 3p 4s 3d 4p.
Befolgen Sie die gleichen Schritte für verschiedene Werte von n+l für jedes Orbital werden die elektronischen Konfigurationen anderer Atome erhalten; was wiederum auch durch das Moeller-Diagramm grafisch bestimmt werden kann.
Schritte zum folgen
Madelungs Regel besagt die Formel n+l, mit denen die elektronische Konfiguration "scharfgeschaltet" werden kann. Wie bereits erwähnt, stellt das Moeller-Diagramm dies jedoch bereits grafisch dar; Folgen Sie einfach den Spalten und zeichnen Sie Schritt für Schritt Diagonalen.
Wie startet man dann die elektronische Konfiguration eines Atoms? Dazu müssen Sie zunächst die Ordnungszahl Z kennen, die per Definition für ein neutrales Atom der Anzahl der Elektronen entspricht.
Somit wird mit Z die Anzahl der Elektronen erhalten, und in diesem Sinne beginnen wir, Diagonalen durch das Moeller-Diagramm zu zeichnen.
Die s-Orbitale können zwei Elektronen aufnehmen (unter Anwendung der Formel 4)l+2) die p sechs Elektronen, die d zehn und die f vierzehn. Es stoppt am Orbital, wo das letzte von Z gegebene Elektron besetzt ist.
Zur weiteren Verdeutlichung finden Sie unten eine Reihe gelöster Übungen.
Gelöste Übungen
Beryllium
Unter Verwendung des Periodensystems befindet sich das Element Beryllium mit einem Z = 4; Das heißt, seine vier Elektronen müssen in den Orbitalen untergebracht sein.
Beginnend mit dem ersten Pfeil im Moeller-Diagramm belegt das 1s-Orbital zwei Elektronen: 1szwei;; gefolgt vom 2s-Orbital mit zwei zusätzlichen Elektronen, um insgesamt 4 zu addieren: 2szwei.
Daher beträgt die Elektronenkonfiguration von Beryllium, ausgedrückt als [Be], 1szwei2szwei. Es ist zu beachten, dass die Summe der hochgestellten Zeichen gleich der Anzahl der Gesamtelektronen ist.
Spiel
Das Element Phosphor hat ein Z = 15 und daher insgesamt 15 Elektronen, die die Orbitale besetzen müssen. Um den Weg voranzutreiben, beginnen Sie sofort mit der Einstellung 1szwei2szwei, welches 4 Elektronen enthält. Dann würden 9 weitere Elektronen fehlen.
Nach dem 2s-Orbital "tritt" der nächste Pfeil durch das 2p-Orbital ein und landet schließlich im 3s-Orbital. Da die 2p-Orbitale 6 Elektronen und die 3s 2 Elektronen einnehmen können, haben wir: 1szwei2szwei2 P.63szwei.
Es fehlen noch 3 weitere Elektronen, die laut Moeller-Diagramm das folgende 3p-Orbital einnehmen: 1szwei2szwei2 P.63szwei3p3, Elektronenkonfiguration von Leuchtstoff [P].
Zirkonium
Das Element Zirkonium hat ein Z = 40. Verkürzungspfad mit 1s Setupzwei2szwei2 P.63szwei3p6, Mit 18 Elektronen (dem des Edelgases Argon) würden 22 weitere Elektronen fehlen. Nach dem 3p-Orbital müssen nach dem Moeller-Diagramm als nächstes die 4s-, 3d-, 4p- und 5s-Orbitale gefüllt werden.
Füllen Sie sie vollständig aus, dh 4szwei, 3d10, 4p6 und 5szwei, Insgesamt werden 20 Elektronen hinzugefügt. Die 2 verbleibenden Elektronen befinden sich daher im folgenden Orbital: dem 4d. Somit ist die Elektronenkonfiguration von Zirkonium [Zr]: 1szwei2szwei2 P.63szwei3p64szwei3d104p65szwei4dzwei.
Iridium
Iridium hat ein Z = 77, also 37 zusätzliche Elektronen im Vergleich zu Zirkonium. Ausgehend von [Cd], dh 1szwei2szwei2 P.63szwei3p64szwei3d104p65szwei4d10, Addiere 29 Elektronen mit den folgenden Orbitalen des Moeller-Diagramms.
Die neuen Orbitale zeichnen neue Diagonalen und sind: 5p, 6s, 4f und 5d. Wenn wir die ersten drei Orbitale vollständig ausfüllen, haben wir: 5p6, 6szwei und 4f14, insgesamt 22 Elektronen zu geben.
Es fehlen also 7 Elektronen, die sich im 5d: 1s-Orbital befinden.zwei2szwei2 P.63szwei3p64szwei3d104p65szwei4d105 p66szwei4f145 d7.
Das Obige ist die Elektronenkonfiguration von Iridium, [Go]. Beachten Sie, dass die 6s-Orbitalezwei und 5d7 sind fett hervorgehoben, um anzuzeigen, dass sie der Valenzschicht dieses Metalls richtig entsprechen.
Ausnahmen vom Moeller-Diagramm und der Madelung-Regel
Es gibt viele Elemente im Periodensystem, die nicht dem entsprechen, was gerade erklärt wurde. Ihre Elektronenkonfigurationen unterscheiden sich experimentell von denen, die aus Quantengründen vorhergesagt wurden..
Zu den Elementen, die diese Diskrepanzen aufweisen, gehören: Chrom (Z = 24), Kupfer (Z = 29), Silber (Z = 47), Rhodium (Z = 45), Cer (Z = 58), Niob (Z = 41) und viele mehr.
Ausnahmen treten sehr häufig beim Füllen der d- und f-Orbitale auf. Zum Beispiel sollte Chrom eine Valenzeinstellung von 4s habenzwei3d4 nach Moellers Diagramm und Madelungs Regel, aber es ist tatsächlich 4s13d5.
Außerdem und schließlich sollte die Silbervalenzeinstellung 5s betragenzwei4d9;; aber es ist wirklich 5s14d10.
Verweise
- Gavira J. Vallejo M. (6. August 2013). Ausnahmen von Madelungs Regel und Moellers Diagramm bei der elektronischen Konfiguration chemischer Elemente. Wiederhergestellt von: triplenlace.com
- Meine Superklasse. (s.f.) Was ist Elektronenkonfiguration? Wiederhergestellt von: misuperclase.com
- Wikipedia. (2018). Moeller-Diagramm. Wiederhergestellt von: es.wikipedia.org
- Dummies. (2018). Darstellung von Elektronen in einem Energieniveaudiagramm. Wiederhergestellt von: dummies.com
- Nave R. (2016). Reihenfolge des Füllens von Elektronenzuständen. Wiederhergestellt von: hyperphysics.phy-astr.gsu.edu



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.