
Eigenschaften, Bildung, Beispiele für quaternäre Verbindungen
Das quaternäre Verbindungen Sie sind alle diejenigen, die vier verschiedene Atome oder Ionen haben. Daher können sie molekulare oder ionische Spezies sein. Ihre Verschiedenartigkeit umfasst sowohl die organische als auch die anorganische Chemie, da es sich um eine sehr umfangreiche Gruppe handelt. obwohl vielleicht nicht so sehr im Vergleich zu binären oder ternären Verbindungen.
Der Grund dafür, dass ihre Anzahl geringer ist, liegt darin, dass die vier Atome oder Ionen durch ihre chemischen Affinitäten zusammengehalten werden müssen. Nicht alle Elemente sind miteinander kompatibel, und noch weniger, wenn ein Quartett betrachtet wird. plötzlich sind zwei von ihnen einander ähnlicher als dem anderen Paar.
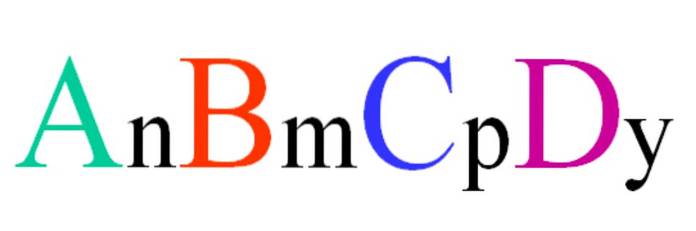
Betrachten Sie eine quaternäre Verbindung der Zufallsformel ABCD. Die Indizes n, m, p und y sind die stöchiometrischen Koeffizienten, die wiederum angeben, welcher Anteil jedes Atoms im Verhältnis zu den anderen vorhanden ist..
Somit ist die Formel A.nB.mC.pD.Y. Es ist gültig, wenn es der Elektroneutralität entspricht. Darüber hinaus ist eine solche Verbindung möglich, wenn ihre vier Atome ausreichend miteinander verwandt sind. Es ist ersichtlich, dass diese Formel nicht für viele Verbindungen gilt, sondern insbesondere für Legierungen oder Mineralien..
Artikelverzeichnis
- 1 Eigenschaften quaternärer Verbindungen
- 1.1 Chemie
- 1.2 Physisch
- 2 Nomenklatur
- 2.1 Saure Oxisales
- 2.2 Grundlegende Oxisales
- 2.3 Doppelsalze
- 2.4 Hydratisierte Salze
- 3 Schulung
- 4 Beispiele
- 5 Referenzen
Eigenschaften von quaternären Verbindungen
Chemisch
Eine quaternäre Verbindung kann ionisch oder kovalent sein und die für ihre Natur erwarteten Eigenschaften aufweisen. Es wird erwartet, dass ionische ABCD-Verbindungen in Wasser, Alkoholen oder anderen polaren Lösungsmitteln löslich sind. Sie sollten hohe Siede- und Schmelzpunkte haben und beim Schmelzen gute Stromleiter sein.
In Bezug auf die kovalenten ABCD-Verbindungen bestehen die meisten aus stickstoffhaltigen, sauerstoffhaltigen oder halogenierten organischen Verbindungen; das heißt, seine Formel würde C werdennH.mODERpN.Y. oder C.nH.mODERpX.Y., wobei X ein Halogenatom ist. Von diesen Molekülen wäre es logisch zu glauben, dass sie angesichts der hohen Elektronegativitäten von O, N und X polar sind.
Eine rein kovalente ABCD-Verbindung kann viele Bindungsmöglichkeiten haben: A-B, B-C, D-A usw., offensichtlich abhängig von den Affinitäten und elektronischen Kapazitäten der Atome. Während in einer rein ionischen ABCD-Verbindung ihre Wechselwirkungen elektrostatisch sind: A.+B.-C.+D.-, beispielsweise.
Im Fall einer Legierung, die eigentlich eher eine feste Mischung als eine Verbindung ist, besteht ABCD aus neutralen Atomen in Grundzuständen (theoretisch).
Im Übrigen kann eine ABCD-Verbindung je nach Identität ihrer Atome neutral, sauer oder basisch sein..
Körperlich
Physikalisch gesehen ist es wahrscheinlich, dass ABCD kein Gas wird, da vier verschiedene Atome immer eine höhere Molekülmasse oder Formel implizieren. Wenn es sich nicht um eine Flüssigkeit mit hohem Siedepunkt handelt, ist zu erwarten, dass es sich um einen Feststoff handelt, dessen Zersetzung viele Produkte erzeugen muss.
Auch hier hängen ihre Farben, ihr Geruch, ihre Textur, ihre Kristalle usw. davon ab, wie A, B, C und D in der Verbindung koexistieren, und hängen von ihren Synergien und Strukturen ab..
Nomenklatur
Bisher wurde das Problem der quaternären Verbindungen global und ungenau angegangen. Abgesehen von der organischen Chemie (Amide, Benzylchloride, quaternäre Ammoniumsalze usw.) gibt es in der anorganischen Chemie genau definierte Beispiele, die als saure und basische Oxysalze bezeichnet werden..
Acid Oxisales
Säureoxysalze sind solche, die aus der teilweisen Neutralisation einer polyprotischen Oxosäure stammen. Somit werden einer oder mehrere seiner Wasserstoffatome durch Metallkationen ersetzt, und je weniger verbleibende Wasserstoffatome vorhanden sind, desto weniger sauer wird er sein..
Zum Beispiel aus Phosphorsäure, H.3PO4, Es können bis zu zwei Säuresalze von beispielsweise Natrium erhalten werden. Dies sind: NaHzweiPO4 (N / A+ ersetzt ein Wasserstoffäquivalent zu H.+) und NazweiHPO4.
Nach der traditionellen Nomenklatur werden diese Salze wie Oxysalze (vollständig deprotoniert) benannt, wobei jedoch das Wort "Säure" vor dem Namen des Metalls steht. So ist das NaHzweiPO4 wäre Natriumsäurephosphat und NazweiHPO4 Natriumsäurephosphat (weil es noch ein H hat).
Andererseits bevorzugt die Bestandsnomenklatur das Wort "Wasserstoff" als "Säure". Das NaHzweiPO4 würde dann Natriumdihydrogenphosphat und Na werdenzweiHPO4 Natriumhydrogenphosphat. Beachten Sie, dass diese Salze vier Atome haben: Na, H, P und O..
Grundlegende Oxisales
Die basischen Oxysalze sind diejenigen, die das OH-Anion in ihrer Zusammensetzung enthalten-. Betrachten Sie zum Beispiel das Salz CaNO3OH (Ca.zwei+ NICHT3- Oh-). Um es zu benennen, würde es ausreichen, dem Namen des Metalls das Wort "grundlegend" vorangestellt zu haben. Daher würde der Name lauten: basisches Calciumnitrat. Und wie wäre es mit dem CuIO?3OH? Sein Name wäre: Kupferbasisches Iodat (Cuzwei+ IO3- Oh-).
Gemäß der Bestandsnomenklatur wird das Wort "basisch" durch Hydroxid ersetzt, gefolgt von der Verwendung eines Bindestrichs vor dem Namen des Oxoanions.
Wenn die vorhergehenden Beispiele wiederholt werden, lauten ihre Namen für jedes: Calciumhydroxidnitrat und Kupfer (II) -hydroxidiodat; Denken Sie daran, dass die Wertigkeit des Metalls in Klammern und mit römischen Ziffern angegeben werden muss.
Doppelsalze
In Doppelsalzen gibt es zwei verschiedene Kationen, die mit demselben Anionentyp interagieren. Angenommen, Doppelsalz: Cu3Glaube (PO4)3 (Cuzwei+ Vertrauen3+ PO43-). Es ist ein Phosphat von Eisen und Kupfer, aber der am besten geeignete Name, um sich darauf zu beziehen, ist: Dreifachphosphat von Kupfer (II) und Eisen (III).
Hydratisierte Salze
Dies sind Hydrate, und der einzige Unterschied besteht darin, dass die Anzahl der zu formulierenden Wasser am Ende ihres Namens angegeben wird. Zum Beispiel das MnClzwei ist Mangan (II) chlorid.
Sein Hydrat MnClzwei4HzweiOder es heißt Mangan (II) -chlorid-Tetrahydrat. Beachten Sie, dass es vier verschiedene Atome gibt: Mn, Cl, H und O..
Ein berühmtes doppelt hydratisiertes Salz ist Mohr's, Fe (NH4)zwei(SW4)zwei6HzweiO. Sein Name ist: doppeltes Eisen (II) sulfat und Ammoniumhexahydrat.
Ausbildung
Wenn man sich wieder auf anorganische quaternäre Verbindungen konzentriert, scheint es, dass sie größtenteils das Produkt partieller Neutralisationen sind. Wenn diese in Gegenwart mehrerer Metalloxide auftreten, ist es wahrscheinlich, dass Doppelsalze entstehen; und wenn das Medium sehr basisch ist, fallen die basischen Oxysalze aus.
Und wenn andererseits die Wassermoleküle eine Affinität zum Metall haben, koordinieren sie direkt mit ihm oder mit den Ionen, die es umgeben, und bilden die Hydrate.
Auf der Legierungsseite müssen vier verschiedene Metalle oder Metalloide geschweißt werden, um Kondensatoren, Halbleiter oder Transistoren herzustellen..
Beispiele
Schließlich wird unten eine Liste mit verschiedenen Beispielen für quaternäre Verbindungen gezeigt. Der Leser kann damit sein Wissen über die Nomenklatur testen:
- PbCO3(OH)zwei
- Cr (HSO4)3
- NaHCO3
- ZnIOH
- Cuzwei(OH)zweiSW3
- LizweiKAsO4
- KURS45HzweiODER
- AgAu (SO4)zwei
- Fall42HzweiODER
- FeCl36HzweiODER
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Nomenklatur und anorganische Formulierung. [PDF]. Wiederhergestellt von: recursostic.educacion.es
- Erika Thalîa Gut. (2019). Doppelsalze. Akademie. Wiederhergestellt von: akademia.edu
- Wikipedia. (2019). Quartäres Ammoniumkation. Wiederhergestellt von: en.wikipedia.org


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.