
Struktur, Verwendung, Eigenschaften von Eisenchlorid (FeCl2)

Das Eisenchlorid ist ein anorganischer Feststoff, der durch Vereinigung eines Fe-Kations gebildet wirdzwei+ und zwei Chloridanionen Cl-. Seine chemische Formel lautet FeClzwei. Es neigt dazu, Wasser aus der Umwelt aufzunehmen. Eines seiner Hydrate ist FeCl-Tetrahydratzwei•4HzweiOder das ist ein grünlicher Feststoff.
Es ist zu beachten, dass es in Wasser sehr gut löslich ist und in Gegenwart von Luft leicht oxidiert und Eisenchlorid FeCl bildet.3. Da es leicht oxidierbar ist und daher als Reduktionsmittel wirken kann, wird es häufig in chemischen und biologischen Forschungslabors verwendet..

Eisenchlorid hat mehrere Verwendungszwecke, von denen der wichtigste darin besteht, anderen Wirkstoffen bei der Oxidation von Schlamm zu helfen, der aus der Abwasser- oder Abwasserbehandlung stammt. Es wird auch im Eisenbeschichtungsprozess von Metallen verwendet und hat einige Anwendungen in der pharmazeutischen Industrie..
Die Verwendung von FeCl wurde ebenfalls experimentiertzwei bei der Rückgewinnung wertvoller Metalle aus verbrauchten Katalysatoren in den Auspuffrohren von Fahrzeugen, die mit Benzin oder Diesel betrieben werden.
Es wird in der Textilindustrie verwendet, um die Farben in einigen Stoffarten zu fixieren.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Spezifisches Gewicht
- 3.6 Löslichkeit
- 3.7 Andere Eigenschaften
- 4 Erhalten
- 5 Verwendungen
- 5.1 Beim Färben von Stoffen
- 5.2 In der Abwasserbehandlung
- 5.3 In chemischen Studien
- 5.4 In biochemischen Studien
- 6 Referenzen
Struktur
Eisenchlorid besteht aus einem Eisenion Fezwei+ und zwei Chloridionen Cl- verbunden durch Ionenbindungen.
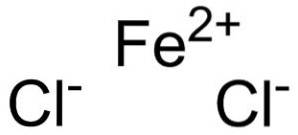
Eisenion Fezwei+ hat folgende elektronische Struktur:
1szwei, 2szwei 2 P.6, 3szwei 3p6 3d6, 4s0
wo zu sehen ist, dass er zwei Elektronen aus der 4s-Schale verloren hat.
Diese Konfiguration ist nicht sehr stabil und neigt aus diesem Grund dazu, zu oxidieren, dh ein anderes Elektron zu verlieren, diesmal aus der 3d-Schicht, wodurch das Fe-Ion gebildet wird.3+.
Das Chloridion Cl seinerseits- hat folgende elektronische Struktur:
1szwei, 2szwei 2 P.6, 3szwei 3p6
wo Sie sehen können, dass es ein zusätzliches Elektron in der 3p-Schale aufgenommen hat, um es zu vervollständigen. Diese Konfiguration ist sehr stabil, da alle elektronischen Schichten vollständig sind.
Nomenklatur
- Eisenchlorid
- Eisen (II) chlorid
- Eisendichlorid
- Eisenchlorid-Tetrahydrat: FeClzwei•4HzweiODER
Eigenschaften
Körperlicher Status
Farbloser bis hellgrüner Feststoff, Kristalle.
Molekulargewicht
126,75 g / mol
Schmelzpunkt
674 ºC
Siedepunkt
1023 ºC
Bestimmtes Gewicht
3,16 bei 25 ºC / 4 ºC
Löslichkeit
In Wasser sehr gut löslich: 62,5 g / 100 ml bei 20 ºC. Löslich in Alkohol, Aceton. In Benzol schwer löslich. In Äther praktisch unlöslich.
Andere Eigenschaften
FeClzwei wasserfrei ist sehr hygroskopisch. Es absorbiert leicht Wasser aus der Umwelt und bildet eine Vielzahl von Hydraten, insbesondere das Tetrahydrat, in dem für jedes FeCl-Molekülzwei Es gibt 4 Moleküle von H.zweiOder daran gebunden (FeClzwei•4HzweiODER).
In Gegenwart von Luft oxidiert es langsam zu FeCl3. Dies bedeutet, dass das Fe-Ionzwei+ leicht zu Fe-Ionen oxidiert3+.
Beim Erhitzen in Gegenwart von Luft bildet sich schnell Eisenchlorid FeCl3 und Eisenoxid FezweiODER3.
FeClzwei Es ist ätzend gegenüber Metallen und Geweben.
Erhalten
Es wird erhalten, indem ein Überschuss an Eisenmetall Fe mit einer wässrigen Lösung von Salzsäure-HCl bei hohen Temperaturen behandelt wird..
Vertrauen0 + 2 HCl → FeClzwei + 2 h+
Aufgrund der Anwesenheit von Wasser durch dieses Verfahren wird jedoch das Eisenchloridtetrahydrat FeCl erhalten.zwei•4HzweiODER.
Um es wasserfrei zu erhalten (ohne Wasser in den Kristallen), haben einige Forscher beschlossen, die Reaktion von Eisenpulver mit wasserfreier HCl (ohne Wasser) im Lösungsmittel Tetrahydrofuran (THF) bei einer Temperatur von 5 ° C durchzuführen..
Auf diese Weise wird die Verbindung FeCl erhaltenzwei•1,5THF, das beim Erhitzen auf 80-85 ºC unter Vakuum oder in einer Stickstoffatmosphäre (um das Vorhandensein von Wasser zu vermeiden) FeCl erzeugtzwei wasserfrei.
Anwendungen
Eisenchlorid hat verschiedene Verwendungszwecke, die im Allgemeinen auf seiner Reduktionskapazität beruhen, dh es kann leicht oxidiert werden. Es wird zum Beispiel in Farben und Beschichtungen verwendet, da es hilft, sie an der Oberfläche zu befestigen.
Eisen ist ein essentieller Mikronährstoff für die Gesundheit von Mensch und Tier. Es ist an der Synthese von Proteinen, an der Atmung und an der Vermehrung von Zellen beteiligt.
Daher das FeClzwei Es wird in pharmazeutischen Präparaten verwendet. Das Fe-Ionzwei+ als solches wird es besser absorbiert als das Fe-Ion3+ im Darm.
Es wird zur Herstellung von FeCl verwendet3. Es wird in der Metallurgie und in Eisenbeschichtungsbädern verwendet, um eine duktilere Ablagerung bereitzustellen.
Hier sind andere Verwendungszwecke.
Bei der Färbung von Stoffen
FeClzwei Es wird in einigen Gewebetypen als Beizmittel oder Farbstofffixiermittel verwendet. Das Beizmittel reagiert chemisch und bindet gleichzeitig an den Farbstoff und das Gewebe, wobei eine unlösliche Verbindung darauf gebildet wird..
Auf diese Weise bleibt der Farbstoff am Stoff fixiert und seine Farbe wird intensiver..
In der Abwasserbehandlung
FeClzwei Verwendung in Abwasser- oder Kläranlagen (Abwasser).
In dieser Anwendung ist Eisenchlorid durch einen als Fenton-Oxidation bezeichneten Prozess an der Oxidation des Schlamms beteiligt. Diese Oxidation bewirkt den Abbau der Schlammflocken und ermöglicht die Freisetzung des stark daran gebundenen Wassers..

Der Schlamm kann dann getrocknet und umweltfreundlich entsorgt werden. Die Verwendung von Eisenchlorid hilft, die Prozesskosten zu senken.
Kürzlich wurde auch vorgeschlagen, es zu verwenden, um die Bildung von Schwefelwasserstoff oder Schwefelwasserstoff in diesen Abwässern zu verringern..
Auf diese Weise würden die durch dieses Gas erzeugte Korrosion und auch unangenehme Gerüche verringert..
In chemischen Studien
Aufgrund seiner reduzierenden Eigenschaften (das Gegenteil von Oxidationsmittel) ist FeClzwei Es wird häufig in verschiedenen Untersuchungen in Laboratorien für Chemie, Physik und Ingenieurwesen eingesetzt.
Einige Wissenschaftler verwendeten Eisenchloriddämpfe, um wertvolle Metalle wie Platin, Palladium und Rhodium aus verbrauchten Katalysatoren in benzin- oder dieselbetriebenen Fahrzeugen zu extrahieren..
Diese Katalysatoren werden verwendet, um Gase zu entfernen, die für Mensch und Umwelt schädlich sind. Sie befinden sich im Auspuff von PKW und LKW, die mit Benzin oder Diesel betrieben werden.

Nach einer gewissen Zeit nutzt sich der Katalysator des Fahrzeugs ab und verliert seine Wirksamkeit und muss ersetzt werden. Der verbrauchte Katalysator wird verworfen und es werden Anstrengungen unternommen, um die darin enthaltenen wertvollen Metalle wiederzugewinnen..

Den Forschern zufolge bildeten diese Metalle mit dem Eisen in Eisenchlorid magnetische Legierungen..
Die Legierungen konnten mit Magneten extrahiert und dann die wertvollen Metalle nach bekannten Methoden gewonnen werden..
In biochemischen Studien
Für den Besitz des Fe-Kationszwei+, Das ist ein wichtiger Mikronährstoff bei Menschen und einigen Tieren, FeClzwei verwendet in Biochemie und Medizinstudien.
Bestimmte Studien haben gezeigt, dass Eisenchlorid die fungizide Wirksamkeit von kaltem Argonplasma verbessert..
Kaltes Plasma ist eine Technologie zur Sterilisation von medizinischen Oberflächen und Instrumenten. Es basiert auf der Bildung von Hydroxylradikalen OH · aus der Luftfeuchtigkeit. Diese Radikale reagieren mit der Zellwand des Mikroorganismus und verursachen dessen Tod.
Bei dieser Untersuchung wurde das FeClzwei verbesserte die Wirkung von kaltem Plasma und beschleunigte die Beseitigung eines Pilzes, der gegen andere Desinfektionsmethoden resistent ist.
Einige Wissenschaftler fanden heraus, dass die Verwendung von FeClzwei ermöglicht es, die Ausbeute in den Reaktionen zu erhöhen, um Glucose ausgehend von Zuckerrohrbagasse zu erhalten.
In diesem Fall ist das Fezwei+ Als wesentliches Mikroelement für die menschliche Gesundheit würde sein Vorhandensein in Spuren im Produkt den Menschen nicht beeinträchtigen.
Verweise
- Fukuda, S. et al. (2019). Eisenchlorid und Eisensulfat verbessern die fungizide Wirksamkeit von kaltem atmosphärischem Argonplasma auf melanisierten Aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28 & ndash; 32. Von ncbi.clm.nih.gov wiederhergestellt.
- Ismal, O.E. und Yildirim, L. (2019). Metallbeizmittel und Biomordantien. In den Auswirkungen und Perspektiven der grünen Chemie für die Textiltechnologie. Kapitel 3, S. 57-82. Von sciencedirect.com wiederhergestellt.
- Zhang, W. et al. (2019). Co-Katalyse von Magnesiumchlorid und Eisenchlorid zur Herstellung von Xylo-Oligosacchariden und Glucose aus Zuckerrohr-Bagasse. Bioresour Technol 2019, 291: 121839. Von ncbi.nlm.nih.gov wiederhergestellt.
- X. Zhou et al. (2015). Rolle des einheimischen Eisens bei der Verbesserung der Entwässerung von Schlamm durch Peroxidation. Scientific Reports 5: 7516. Von ncbi.nlm.nih.gov wiederhergestellt.
- Rathnayake, D. et al. (2019). Schwefelwasserstoffkontrolle in Abwasserkanälen durch Katalyse der Reaktion mit Sauerstoff. Wissenschaft der gesamten Umwelt 689 (2019) 1192-1200. Von ncbi.nlm.nih.gov wiederhergestellt.
- Taninouchi, Y. und Okabe, T.H. (2018). Rückgewinnung von Metallen der Platingruppe aus verbrauchten Katalysatoren mittels Eisenchloriddampfbehandlung. Metall and Materi Trans B (2018) 49: 1781. Von link.springer.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Eisenchlorid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. et al. (1977). Eisen (0) -Oxidation durch Chlorwasserstoff in Tetrahydrofuran: ein einfacher Weg zu wasserfreiem Eisen (II) -chlorid. Inorganic Chemistry, Band 16, Nr. 7, 1977. Wiederhergestellt von pubs.acs.org.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.