
Struktur, Eigenschaften, Verwendungen der Chromchlorid (CrCl3)
Das Chromchlorid (CrCl3) ist ein anorganisches Salz aus Cr-Kationen3+ und Cl-Anionen- im Verhältnis 1: 3; das heißt, für jedes Cr3+ Es gibt drei Cl-. Wie später zu sehen sein wird, sind ihre Wechselwirkungen nicht ionisch. Dieses Salz kann in zwei Formen vorliegen: wasserfrei und Hexahydrat..
Die wasserfreie Form zeichnet sich durch eine rötlich-violette Farbe aus; während das Hexahydrat CrCl3.6HzweiOder es ist dunkelgrün. Der Einbau der Wassermoleküle verändert die physikalischen Eigenschaften der Kristalle; wie ihre Siede- und Schmelzpunkte, Dichten usw..

Chrom (III) -chlorid (gemäß der Stammnomenklatur) zersetzt sich bei hohen Temperaturen und wandelt sich in Chrom (II) -chlorid, CrCl, umzwei. Es ist korrosiv gegenüber Metallen, obwohl es beim Verchromen verwendet wird: Ein Verfahren, bei dem Metalle mit einer dünnen Chromschicht beschichtet werden.
Die cr3+, Aufgrund seines jeweiligen Chlorids wurde es zur Behandlung von Diabetes eingesetzt, insbesondere bei Patienten mit totaler parenteraler Ernährung (TPN), die nicht die erforderliche Menge Chrom aufnehmen. Die Ergebnisse sind jedoch viel besser (und zuverlässiger), wenn sie als Picolinat geliefert werden..
Artikelverzeichnis
- 1 Struktur von Chromchlorid
- 1.1 Kristalline Schichten wasserfrei
- 2 Eigenschaften
- 2.1 Namen
- 2.2 Chemische Formel
- 2.3 Molekulargewicht
- 2.4 Physikalische Beschreibung
- 2.5 Schmelzpunkt
- 2.6 Siedepunkt
- 2.7 Löslichkeit in Wasser
- 2.8 Löslichkeit in organischen Lösungsmitteln
- 2.9 Dichte
- 2.10 Lagertemperatur
- 2.11 Zersetzung
- 2.12 Korrosion
- 2.13 Reaktionen
- 2,14 pH
- 3 Synthese
- 4 Verwendungen
- 4.1 Industrie
- 4.2 Therapeutika
- 5 Risiken
- 6 Referenzen
Chromchloridstruktur
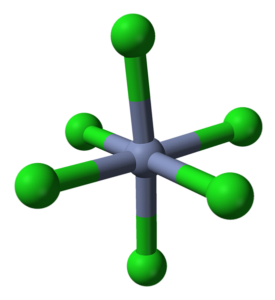
Das CrCl3 Obwohl es sich um ein Salz handelt, sind die Wechselwirkungen nicht rein ionisch. einen bestimmten kovalenten Charakter haben, Produkt der Koordination zwischen Cr3+ und Cl-, die zu einem deformierten Oktaeder führen (oberes Bild). Chrom befindet sich in der Mitte des Oktaeders und Chlor in seinen Eckpunkten.
Das Oktaeder CrCl6 kann auf den ersten Blick der CrCl-Formel widersprechen3;; Dieses vollständige Oktaeder definiert jedoch nicht die Einheitszelle des Kristalls, sondern einen Würfel (ebenfalls deformiert), der die grünen Kugeln oder Chloranionen in zwei Hälften schneidet.
Wasserfreie kristalline Schichten
Somit behält die Einheitszelle mit diesem Oktaeder immer noch das Verhältnis 1: 3 bei. Durch Reproduktion dieser deformierten Würfel im Raum wird der CrCl-Kristall erhalten3, Dies wird im oberen Bild mit einem dreidimensionalen Füllmodell und einem Modell von Kugeln und Balken dargestellt.

Diese kristalline Schicht ist eine von vielen, aus denen die schuppigen rotvioletten Kristalle von CrCl bestehen.3 (Verwechseln Sie nicht die Farbe des Kristalls mit der der grünen Kugeln).
Wie zu sehen ist, sind die Anionen Cl- Sie besetzen die Oberfläche, so dass ihre negativen Ladungen die anderen kristallinen Schichten abstoßen. Folglich werden die Kristalle schuppig und spröde; aber glänzend, wegen des Chroms.
Wenn dieselben Schichten aus einer lateralen Perspektive sichtbar gemacht werden, werden anstelle von Oktaedern verzerrte Tetraeder beobachtet:
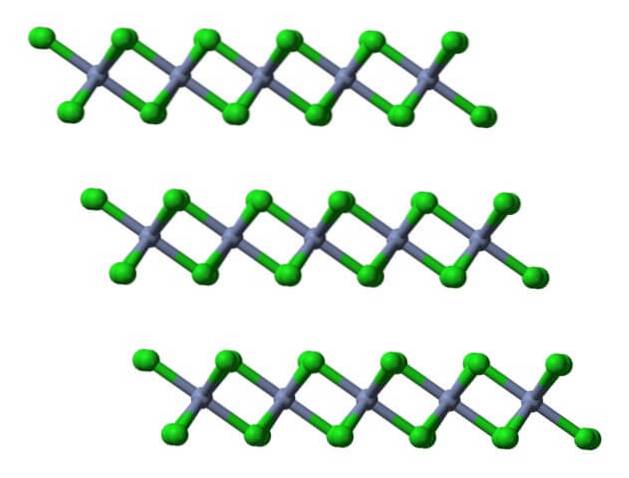
Hier wird das Verständnis weiter erleichtert, warum sich die Schichten gegenseitig abstoßen, wenn Cl-Anionen binden.- ihrer Oberflächen.
Eigenschaften
Namen
-Chrom (III) chlorid
-Chrom (III) -trichlorid
-Chrom (III) chlorid wasserfrei.
Chemische Formel
-CrCl3 (wasserfrei).
-CrCl3.6HzweiO (Hexahydrat).
Molekulargewicht
-158,36 g / mol (wasserfrei).
-266,43 g / mol (Hexahydrat).
Physische Beschreibung
-Rötlich-violette Feststoffe und Kristalle (wasserfrei).
-Dunkelgrünes kristallines Pulver (Hexahydrat, unteres Bild). In diesem Hydrat ist zu sehen, wie Wasser den Glanz hemmt, ein metallisches Merkmal von Chrom.

Schmelzpunkt
-1.152 ºC (2.106 ºF, 1.425 K) (wasserfrei)
-83 ºC (Hexahydrat).
Siedepunkt
1300ºC (2370ºF, 1,570) (wasserfrei).
Wasserlöslichkeit
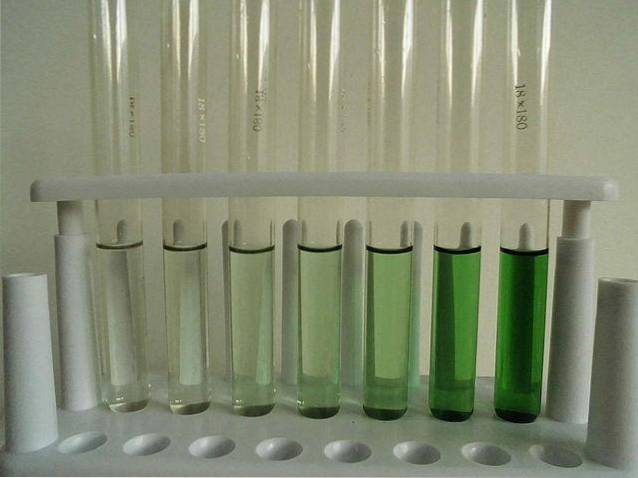
-Leicht löslich (wasserfrei).
-585 g / l (Hexahydrat).
Das Bild oben zeigt eine Reihe von Reagenzgläsern, die mit einer wässrigen CrCl-Lösung gefüllt sind3. Beachten Sie, dass die Farbe des Komplexes umso intensiver ist, je konzentrierter es ist [Cr (OHzwei)6]]3+, verantwortlich für die grüne Farbe.
Löslichkeit in organischen Lösungsmitteln
Löslich in Ethanol, aber unlöslich in Ether (wasserfrei).
Dichte
-2,87 g / cm3 (wasserfrei).
-2,76 g / cm3 (Hexahydrat).
Lagertemperatur
Zersetzung
Chrom (III) -chlorid setzt beim Erhitzen bis zur Zersetzung giftige Dämpfe chlorhaltiger Verbindungen frei. Diese Verbindungen werden auch freigesetzt, wenn Chrom (III) -chlorid mit starken Säuren in Kontakt kommt..
Korrosion
Es ist stark ätzend und kann bestimmte Stähle angreifen.
Reaktionen
Es ist nicht kompatibel mit starken Oxidationsmitteln. Es reagiert auch stark mit Lithium und Stickstoff..
Wenn es in Gegenwart von Wasserstoff erhitzt wird, reduziert es sich unter Bildung von Chlorwasserstoff zu Chrom (II) chlorid.
2 CrCl3 + H.zwei => 2 CrClzwei + 2 HCl
pH
In einer wässrigen Lösung und mit einer Konzentration von 0,2 M: 2,4.
Synthese
Chrom (III) chloridhexahydrat wird durch Umsetzung von Chromhydroxid mit Salzsäure und Wasser hergestellt.
Cr (OH)3 + 3 HCl + 3 H.zweiO => CrCl3.6HzweiODER
Um das wasserfreie Salz zu erhalten, wird das CrCl erhitzt3.6HzweiOder in Gegenwart von Thionylchlorid, SOClzwei, Salzsäure und Hitze:
[Cr (H.zweiODER)6] Cl3 + 6SOClzwei + ∆ → CrCl3 + 12 HCl + 6 SOzwei
Alternativ kann CrCl3 erhalten durch Leiten von Chlorgas über ein Gemisch aus Chrom und Kohlenoxid.
CrzweiODER3 + 3 C + Clzwei => 2 CrCl3 + 3 CO
Und schließlich ist es die am häufigsten verwendete Methode, das Oxid mit einem Halogenierungsmittel wie Tetrachlorkohlenstoff zu erhitzen:
CrzweiODER3 + 3CCl4 + → 2CrCl3 + 3COClzwei
Anwendungen
Industriell
Chromchlorid ist an der In-situ-Herstellung von Chrom (II) -chlorid beteiligt; Reagenz, das an der Reduktion von Alkylhalogeniden und an der Synthese von (E) -Alkenylhalogeniden beteiligt ist.
-Es wird in der Verchromungstechnik eingesetzt. Dies besteht darin, mittels Galvanisieren eine dünne Chromschicht auf Metallgegenständen oder anderem Material mit einem dekorativen Objektiv abzuscheiden, wodurch die Korrosionsbeständigkeit und auch die Oberflächenhärte erhöht werden..
-Es wird als Textilbeizmittel verwendet und dient als Verbindung zwischen dem Färbematerial und den zu färbenden Stoffen. Darüber hinaus wird es als Katalysator für die Herstellung von Olefinen und Imprägniermitteln verwendet..
Therapeutika
Die Verwendung eines USP-Chromchlorid-Ergänzungsmittels wird bei Patienten empfohlen, die nur intravenöse Lösungen erhalten, die zur vollständigen parenteralen Ernährung (TPN) verabreicht werden. Daher nur, wenn diese Patienten nicht alle ihre Ernährungsbedürfnisse erhalten.
Chrom (III) ist Teil des Glukosetoleranzfaktors, einem Aktivator für insulinfördernde Reaktionen. Es wird angenommen, dass Chrom (III) den Glukose-, Protein- und Lipidstoffwechsel aktiviert und die Wirkung von Insulin bei Menschen und Tieren erleichtert.
Chrom ist in vielen Lebensmitteln enthalten. Die Konzentration überschreitet jedoch nicht 2 pro Portion, wobei Brokkoli das Lebensmittel mit dem höchsten Beitrag (11 µg) ist. Zusätzlich ist die intestinale Absorption von Chrom mit einem Wert von 0,4 bis 2,5% der aufgenommenen Menge gering..
Dies macht es schwierig, eine Diät für die Versorgung mit Chrom zu etablieren. 1989 empfahl die Nationale Akademie der Wissenschaften 50 bis 200 µg / Tag als ausreichende Chromaufnahme..
Risiken
Zu den möglichen Risiken beim Verzehr dieses Salzes als Chromzusatz gehören:
-Starke Bauchschmerzen.
-Abnormale Blutungen, die von Schwierigkeiten bei der Wundheilung über rötliche Blutergüsse bis hin zur Verdunkelung des Stuhls aufgrund innerer Blutungen reichen können.
-Reizungen im Verdauungssystem, die Geschwüre im Magen oder Darm verursachen.
-Dermatitis
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Chrom (III) chlorid. Wiederhergestellt von: en.wikipedia.org
- Chrom (III) chlorid [PDF]. Wiederhergestellt von: alpha.chem.umb.edu
- PubChem. (2019). Chromchloridhexahydrat. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Nationales Gesundheitsinstitut. (21. September 2018). Chrom: Fact Sheet zu Nahrungsergänzungsmitteln. Wiederhergestellt von: ods.od.nih.gov
- Tomlinson Carole A. (2019). Chromchlorid Nebenwirkungen. Leaf Group Ltd. Wiederhergestellt von: healthfully.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.