
Aldehyde Struktur, Eigenschaften, Verwendungen und Beispiele

Das Aldehyde es sind organische Verbindungen mit der allgemeinen Formel RCHO. R eine aliphatische oder aromatische Kette darstellt; C zu Kohlenstoff; O zu Sauerstoff und H zu Wasserstoff. Sie zeichnen sich durch eine Carbonylgruppe wie Ketone und Carbonsäuren aus, weshalb Aldehyde auch als Carbonylverbindungen bezeichnet werden.
Die Carbonylgruppe verleiht dem Aldehyd viele seiner Eigenschaften. Sie sind Verbindungen, die leicht oxidieren und sehr reaktiv auf nukleophile Additionen sind. Die Doppelbindung der Carbonylgruppe (C = O) hat zwei Atome, die sich in ihrer Gier nach Elektronen unterscheiden (Elektronegativität).
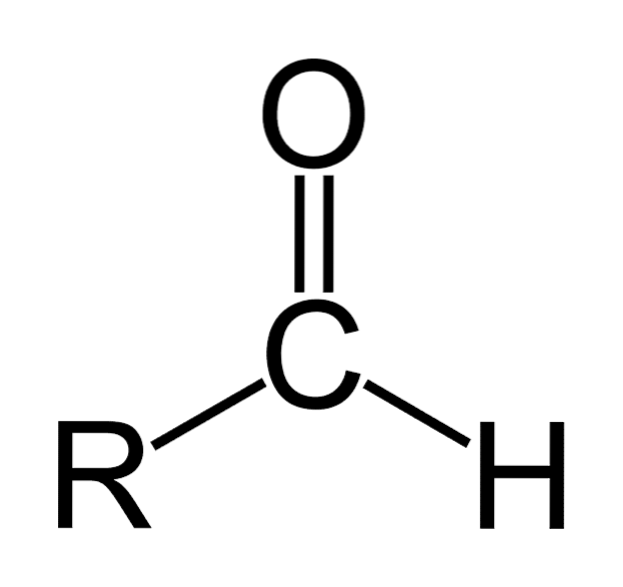
Sauerstoff zieht Elektronen mit größerer Kraft als Kohlenstoff an, daher bewegt sich die Elektronenwolke darauf zu und macht die Doppelbindung zwischen Kohlenstoff und Sauerstoff von Natur aus polar mit einem signifikanten Dipolmoment. Dies macht Aldehyde zu polaren Verbindungen..
Die Polarität der Aldehyde beeinflusst ihre physikalischen Eigenschaften. Der Siedepunkt und die Löslichkeit von Aldehyden in Wasser sind höher als bei unpolaren chemischen Verbindungen mit ähnlichen Molekulargewichten, wie dies bei Kohlenwasserstoffen der Fall ist..
Aldehyde mit weniger als fünf Kohlenstoffatomen sind wasserlöslich, da Wasserstoffbrücken zwischen dem Sauerstoff der Carbonylgruppe und dem Wassermolekül gebildet werden. Eine Erhöhung der Anzahl der Kohlenstoffe in der Kohlenwasserstoffkette führt jedoch zu einer Erhöhung des unpolaren Anteils des Aldehyds, wodurch dieser in Wasser weniger löslich wird..
Aber wie sind sie und woher kommen sie? Obwohl seine Natur im Wesentlichen von der Carbonylgruppe abhängt, trägt auch der Rest der Molekülstruktur viel zum Ganzen bei. Somit können sie von beliebiger Größe sein, klein oder groß, oder sogar ein Makromolekül kann Regionen aufweisen, in denen der Charakter von Aldehyden überwiegt..
So gibt es wie bei allen chemischen Verbindungen "angenehme" Aldehyde und andere bittere. Sie können in natürlichen Quellen gefunden oder in großem Maßstab synthetisiert werden. Beispiele für Aldehyde sind Vanillin, das in Eiscreme sehr vorhanden ist (oberes Bild), und Acetaldehyd, das alkoholischen Getränken Geschmack verleiht..
Artikelverzeichnis
- 1 Chemische Struktur
- 2 Physikalische und chemische Eigenschaften
- 2.1 Schmelzpunkte
- 2.2 Siedepunkte
- 2.3 Löslichkeit in Wasser, ausgedrückt in g / 100 g H2O
- 3 Reaktivität
- 3.1 Oxidationsreaktion
- 3.2 Reduktion auf Alkohole
- 3.3 Reduktion zu Kohlenwasserstoffen
- 3.4 Nucleophile Addition
- 4 Nomenklatur
- 5 Verwendungen
- 5.1 Formaldehyd
- 5.2 Bakelit
- 5.3 Sperrholz
- 5.4 Polyurethan
- 5.5 Butyraldehyd
- 5.6 Acetaldehyd
- 5.7 Synthese
- 6 Beispiele für Aldehyde
- 6.1 Glutaraldehyd
- 6.2 Benzaldehyd
- 6.3 Glycerinaldehyd
- 6.4 Glycerinaldehyd-3-phosphat
- 6,5 11-cis-Retinal
- 6.6 Pyridoxalphosphat (Vitamin B6)
- 6.7 Salicylaldehyd
- 7 Referenzen
Chemische Struktur

Aldehyde bestehen aus einem Carbonyl (C = O), an das ein Wasserstoffatom direkt gebunden ist. Dies unterscheidet es von anderen organischen Verbindungen wie Ketonen (R.zweiC = O) und Carbonsäuren (RCOOH).
Das obere Bild zeigt die Molekülstruktur um -CHO, eine Formylgruppe. Die Formylgruppe ist flach, da Kohlenstoff und Sauerstoff eine sp-Hybridisierung aufweisenzwei. Diese Planarität macht es anfällig für Angriffe durch nukleophile Spezies und daher leicht oxidierbar..
Worauf bezieht sich diese Oxidation? Zur Bildung einer Bindung mit einem anderen Atom, das elektronegativer als Kohlenstoff ist; und im Fall von Aldehyden ist es ein Sauerstoff. Somit wird der Aldehyd zu einer Carbonsäure -COOH oxidiert. Was ist, wenn der Aldehyd reduziert wurde? An seiner Stelle würde sich ein primärer Alkohol bilden, ROH.
Aldehyde werden nur aus primären Alkoholen hergestellt: solchen, bei denen sich die OH-Gruppe am Ende einer Kette befindet. Ebenso die Formylgruppe für immer befindet sich am Ende einer Kette oder ragt als Substituent aus dieser oder dem Ring heraus (wenn es andere wichtigere Gruppen gibt, wie z. B. -COOH).
Physikalische und chemische Eigenschaften
Da es sich um polare Verbindungen handelt, sind ihre Schmelzpunkte höher als die von unpolaren Verbindungen. Aldehydmoleküle können nicht über Wasserstoffbrücken intermolekular binden, da sie nur Kohlenstoffatome aufweisen, die an Wasserstoffatome gebunden sind..
Aufgrund des oben Gesagten haben Aldehyde niedrigere Siedepunkte als Alkohole und Carbonsäuren.
Schmelzpunkte
Formaldehyd -92; Acetaldehyd -121; Propionaldehyd -81; n-Butyraldehyd -99; n-Valeraldehyd -91; Caproaldehyd -; Heptaldehyd - 42; Phenylacetaldehyd -; Benzaldehyd -26.
Siedepunkte
Formaldehyd -21; Acetaldehyd 20; Propionaldehyd 49; n-Butyraldehyd 76; n-Valeraldehyd 103; Caproaldehyd 131; Heptaldehyd 155; Phenylacetaldehyd 194; Benzaldehyd 178.
Löslichkeit in Wasser ausgedrückt in g / 100 g H.zweiODER
Formaldehyd, sehr löslich; Acetaldehyd, unendlich; Propionaldehyd, 16; n-Butyraldehyd, 7; n-Valeraldehyd, schwer löslich; Caproaldehyd, schwer löslich; Leicht löslicher Phenylacetaldehyd; Benzaldehyd, 0,3.
Die Siedepunkte von Aldehyden neigen dazu, direkt mit dem Molekulargewicht anzusteigen. Im Gegenteil, es besteht die Tendenz, die Löslichkeit von Aldehyden in Wasser mit zunehmendem Molekulargewicht zu verringern. Dies spiegelt sich in den physikalischen Konstanten der gerade erwähnten Aldehyde wider..
Reaktivität
Oxidationsreaktion
Aldehyde können in Gegenwart einer dieser Verbindungen zu der entsprechenden Carbonsäure oxidiert werden: Ag (NH3)zwei, KMnO4 in OrdnungzweiCrzweiODER7.
Reduktion auf Alkohole
Sie können mit Hilfe von Nickel-, Platin- oder Palladiumkatalysatoren hydriert werden. Somit wird C = O zu C-OH.
Reduktion zu Kohlenwasserstoffen
In Gegenwart von Zn (Hg), konzentrierter HCl oder in NHzweiNHzwei Aldehyde verlieren die Carbonylgruppe und werden zu Kohlenwasserstoffen.
Nucleophile Addition
Es gibt mehrere Verbindungen, die der Carbonylgruppe hinzugefügt werden, darunter: Grignard-Reagenzien, Cyanid, Derivate von Ammoniak und Alkohole.
Nomenklatur
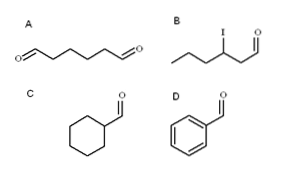
Im obigen Bild sind vier Aldehyde dargestellt. Wie heißen sie??
Da es sich um oxidierte primäre Alkohole handelt, wird der Name des Alkohols von -ol in -al geändert. Somit ist Methanol (CH3OH) wenn zu CH oxidiert3CHO heißt Methanal (Formaldehyd); CH3CHzweiCHO-Ethanal (Acetaldehyd); CH3CHzweiCHzweiCHO Propanal und CH3CHzweiCHzweiCHzweiCHO Butanal.
Alle neu benannten Aldehyde haben die -CHO-Gruppe am Ende der Kette. Wenn es wie in A an beiden Enden gefunden wird, wird der Endung -al das Präfix di- vorangestellt. Da A sechs Kohlenstoffe hat (einschließlich derjenigen beider Formylgruppen), leitet es sich von 1-Hexanol ab und heißt daher: Hexanwählen.
Wenn ein Substituent wie ein Alkylradikal, eine Doppel- oder Dreifachbindung oder ein Halogen vorhanden ist, werden die Kohlenstoffe der Hauptkette aufgelistet, wobei -CHO die Nummer 1 erhält. Daher wird Aldehyd B als 3-Iodhexanal bezeichnet.
In den Aldehyden C und D hat die Gruppe -CHO jedoch keine Priorität, solche Verbindungen von anderen zu identifizieren. C ist ein Cycloalkan, während D ein Benzol ist, wobei beide eines ihrer Hs durch eine Formylgruppe substituiert sind.
In ihnen wird die Formylgruppe als Carbaldehyd bezeichnet, da die Hauptstruktur cyclisch ist. Somit ist C Cyclohexancarbaldehyd und D Benzolcarbaldehyd (besser bekannt als Benzaldehyd)..
Anwendungen
Aldehyde kommen in der Natur vor und können angenehme Aromen verleihen, wie dies bei Zimtaldehyd der Fall ist, der für den charakteristischen Geschmack von Zimt verantwortlich ist. Deshalb werden sie häufig als künstliche Aromen in vielen Produkten wie Süßigkeiten oder Lebensmitteln verwendet..
Formaldehyd
Formaldehyd ist der am meisten industriell hergestellte Aldehyd. Der durch Oxidation von Methanol erhaltene Formaldehyd wird in einer 37% igen Lösung des Gases in Wasser unter dem Namen Formalin verwendet. Dies wird beim Gerben von Häuten und bei der Konservierung und Einbalsamierung von Leichen verwendet..
Ebenso wird Formaldehyd als Germizid, Fungizid und Insektizid für Pflanzen und Gemüse verwendet. Sein größter Nutzen ist jedoch der Beitrag zur Herstellung von Polymermaterial. Der als Bakelit bezeichnete Kunststoff wird durch die Reaktion zwischen Formaldehyd und Phenol synthetisiert.
Bakelit
Bakelit ist ein sehr hartes Polymer mit einer dreidimensionalen Struktur, das in vielen Haushaltsgegenständen wie Griffen für Töpfe, Pfannen, Kaffeemaschinen, Messer usw. verwendet wird..
Bakelit-ähnliche Polymere werden aus Formaldehyd in Kombination mit den Verbindungen Harnstoff und Melamin hergestellt. Diese Polymere werden nicht nur als Kunststoffe, sondern auch als Klebstoff und Beschichtungsmaterial verwendet..
Sperrholz
Das Sperrholz ist der Handelsname eines Materials, das aus dünnen Holzplatten besteht, die durch aus Formaldehyd hergestellte Polymere verbunden sind. Die Marken Formica und Melmac werden unter Beteiligung des letzteren hergestellt. Formica ist ein Kunststoff, der für Möbelbezüge verwendet wird.
Melmac-Kunststoff wird zur Herstellung von Tellern, Gläsern, Tassen usw. verwendet. Formaldehyd ist der Rohstoff für die Synthese der Verbindung Methylen-Diphenyldiisocyanat (MDI), einer Vorstufe von Polyurethan.
Polyurethan
Polyurethan wird als Isolator in Kühl- und Gefrierschränken sowie als Polsterung für Möbel, Matratzen, Beschichtungen, Klebstoffe, Sohlen usw. verwendet..
Butyraldehyd
Butyraldehyd ist der Hauptvorläufer für die Synthese von 2-Ethylhexanol, das als Weichmacher verwendet wird. Es hat ein angenehmes Apfelaroma, das seine Verwendung in Lebensmitteln als Aroma ermöglicht.
Es wird auch zur Herstellung von Gummibeschleunigern verwendet. Interveniert als Zwischenreagenz bei der Herstellung von Lösungsmitteln.
Acetaldehyd
Acetaldehyd wurde zur Herstellung von Essigsäure verwendet. Diese Rolle von Acetaldehyd hat jedoch an Bedeutung verloren, da es durch den Carbonylierungsprozess von Methanol verdrängt wurde..
Synthese
Andere Aldehyde sind Vorläufer von Oxoalkoholen, die bei der Herstellung von Waschmitteln verwendet werden. Sogenannte Oxoalkohole werden durch Zugabe von Kohlenmonoxid und Wasserstoff zu einem Olefin hergestellt, um einen Aldehyd zu erhalten. Und schließlich wird der Aldehyd hydriert, um den Alkohol zu erhalten.
Einige Aldehyde werden zur Herstellung von Parfums verwendet, wie dies bei Chanel Nr. 5 der Fall ist. Viele Aldehyde natürlichen Ursprungs haben angenehme Gerüche, zum Beispiel: Heptanal riecht nach grünem Gras; das Oktanal ein Orangengeruch; das Nonanal roch nach Rosen und das Citral nach Limette.
Beispiele für Aldehyde
Glutaraldehyd
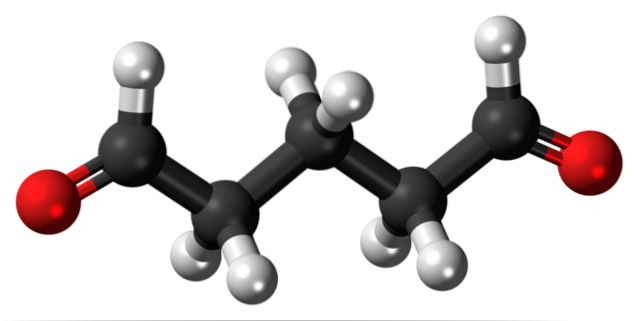
Glutaraldehyd hat an beiden Enden zwei Formylgruppen in seiner Struktur.
Es wird unter dem Namen Cidex oder Glutaral vertrieben und als Desinfektionsmittel zur Sterilisation chirurgischer Instrumente verwendet. Es wird verwendet, um Warzen an den Füßen zu behandeln und es als Flüssigkeit aufzutragen. Es wird auch als Gewebefixiermittel in Laboratorien für Histologie und Pathologie verwendet..
Benzaldehyd
Es ist der einfachste aromatische Aldehyd, der durch einen Benzolring gebildet wird, an den eine Formylgruppe gebunden ist.
Es ist in Mandelöl enthalten, daher sein charakteristischer Geruch, der es ermöglicht, es als Lebensmittelaroma zu verwenden. Darüber hinaus wird es bei der Synthese von organischen Verbindungen im Zusammenhang mit der Herstellung von Arzneimitteln und bei der Herstellung von Kunststoffen verwendet..
Glycerinaldehyd
Es ist eine Aldotriose, ein Zucker aus drei Kohlenstoffatomen. Es hat zwei Isomere, die als D- und L-Enantiomere bezeichnet werden. Glycerinaldehyd ist das erste Monosaccharid, das während der Dunkelphase (Calvin-Zyklus) bei der Photosynthese erhalten wird..
Glycerinaldehyd-3-phosphat
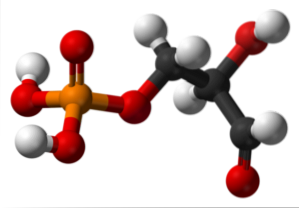
Das obere Bild zeigt die Struktur von Glycerinaldehyd-3-phosphat. Die roten Kugeln neben der gelben entsprechen der Phosphatgruppe, während die schwarzen dem Kohlenstoffgerüst entsprechen. Die rote Kugel, die mit der weißen verbunden ist, ist die OH-Gruppe, aber wenn sie mit der schwarzen Kugel und die letztere mit der weißen verbunden ist, dann ist es die CHO-Gruppe.
Glycerinaldehyd-3-phosphat ist an der Glykolyse beteiligt, einem Stoffwechselprozess, bei dem Glukose unter Bildung von ATP, einem Energiereservoir von Lebewesen, zu Brenztraubensäure abgebaut wird. Neben der Herstellung von NADH, einem biologischen Reduktionsmittel.
Bei der Glykolyse stammen Glycerinaldehyd-3-phosphat und Dihydroacetonphosphat aus der Spaltung von D-Fructose-1-6-bisphosphat
Glycerinaldehyd-3-phosphat ist am Stoffwechselprozess beteiligt, der als Pentosezyklus bekannt ist. Darin wird NADPH, ein wichtiger biologischer Reduktionsmittel, erzeugt..
11-cis-Retinal
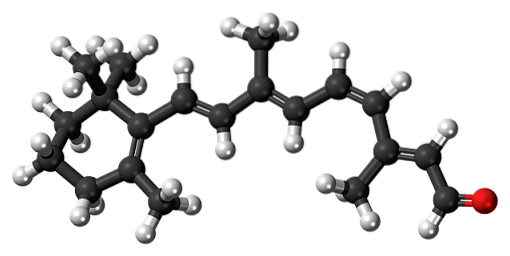
Β-Carotin ist ein natürliches Pigment, das in verschiedenen Gemüsesorten, insbesondere Karotten, enthalten ist. Es wird in der Leber oxidativ abgebaut und wandelt sich so in Retinolalkohol oder Vitamin A um. Die Oxidation von Vitamin A und die anschließende Isomerisierung einer seiner Doppelbindungen bildet den 11-cis-retinalen Aldehyd.
Pyridoxalphosphat (Vitamin B6)
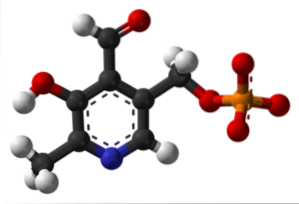
Es ist eine prothetische Gruppe, die mit mehreren Enzymen verbunden ist. Dies ist die aktive Form von Vitamin B6 und ist am Synthesevorgang des inhibitorischen Neurotransmitters GABA beteiligt.
Wo ist die Formylgruppe in Ihrer Struktur? Beachten Sie, dass sich dies von den übrigen Gruppen unterscheidet, die mit dem aromatischen Ring verbunden sind.
Salicylaldehyd
Es ist ein Rohstoff für die Synthese von Acetylsalicylsäure, einem als Aspirin bekannten Analgetikum und Antipyretikum..
Verweise
- Robert C. Neuman, Jr. Kapitel 13, Carbonylverbindungen: Ketone, Aldehyde, Carbonsäuren. [PDF]. Entnommen aus: chem.ucr.edu
- Germán Fernández. (14. September 2009). Nomenklatur der Aldehyde. Entnommen aus: quimicaorganica.net
- T.W. Graham Solomons, Craigh B. Fryhle. Organische Chemie. (Zehnte Ausgabe, S. 729-731) Wiley Plus.
- Jerry March und William H. Brown. (31. Dezember 2015). Aldehyd. Entnommen aus: britannica.com
- Wikipedia. (2018). Aldehyde. Entnommen aus: https://en.wikipedia.org/wiki/Aldehyde
- Morrison, R. T. und Boyd, R. N. (1990). Organische Chemie Fünfte Ausgabe. Editorial Addison-Wesley Iberoamericana.
- Carey, F. A. (2006). Organische Chemie Sechste Ausgabe. Mc Graw Hill Verlag.
- Mathews, Ch. K., Van Holde, K. E. und Athern, K. G. (2002). Biochemie. Dritte Edition. Herausgeber Pearson Adisson Wesley.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.