
Eigenschaften, Verwendungen und Beispiele halogenierter Derivate

Das halogenierte Derivate sind alle Verbindungen, die ein Halogenatom haben; das heißt, eines der Elemente der Gruppe 17 (F, Cl, Br, I). Diese Elemente unterscheiden sich von den anderen dadurch, dass sie elektronegativer sind und eine Vielfalt anorganischer und organischer Halogenide bilden..
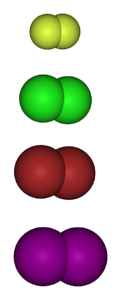
Das Bild unten zeigt die gasförmigen Moleküle der Halogene. Von oben nach unten: Fluor (F.zwei), Chlor (Clzwei), Brom (Brzwei) und Jod (I.zwei). Jedes von diesen hat die Fähigkeit, mit der überwiegenden Mehrheit der Elemente zu reagieren, selbst zwischen Kongeneren derselben Gruppe (Interhalogene)..
Somit haben halogenierte Derivate die Formel MX, wenn es sich um ein Metallhalogenid handelt, RX, wenn es Alkyl ist, und ArX, wenn es aromatisch ist. Die letzten beiden gehören zur Kategorie der organischen Halogenide. Die Stabilität dieser Verbindungen erfordert einen Energie "Vorteil" im Vergleich zum ursprünglichen Gasmolekül.
In der Regel bildet Fluor stabilere halogenierte Derivate als Jod. Der Grund liegt in den Unterschieden zwischen ihren Atomradien (die violetten Kugeln sind voluminöser als die gelben).
Mit zunehmendem Atomradius ist die Überlappung der Orbitale zwischen dem Halogen und dem anderen Atom schlechter und daher die Bindung schwächer..
Artikelverzeichnis
- 1 Nomenklatur
- 1.1 Anorganika
- 1.2 Bio
- 2 Eigenschaften
- 2.1 Anorganische Halogenide
- 2.2 Organische Halogenide
- 3 Verwendungen
- 4 Zusätzliche Beispiele
- 5 Referenzen
Nomenklatur
Die richtige Benennung dieser Verbindungen hängt davon ab, ob sie anorganisch oder organisch sind..
Anorganisch
Metallhalogenide bestehen aus einer ionischen oder kovalenten Bindung zwischen einem Halogen X und einem Metall M (aus den Gruppen 1 und 2, Übergangsmetallen, Schwermetallen usw.)..
In diesen Verbindungen haben alle Halogene eine Oxidationsstufe von -1. Warum? Weil seine Valenzeinstellungen ns sindzweinp5.
Daher müssen sie nur ein Elektron gewinnen, um das Valenzoktett zu vervollständigen, während Metalle oxidieren und ihnen die Elektronen geben, die ihnen zur Verfügung stehen..
Somit bleibt das Fluor als F.-, Fluorid; das Cl-, Chlorid; der BR-, Bromid; und das ich-, Ich zuletzt. MF würde benannt werden: (Metallname) Fluorid (n), wobei n die Wertigkeit des Metalls nur ist, wenn es mehr als eins hat. Für Metalle der Gruppen 1 und 2 ist es nicht erforderlich, die Valenz zu benennen.
Beispiele
- NaF: Natriumfluorid.
- CaClzwei: Calciumchlorid.
- AgBr: Silberbromid.
- ZnIzwei: Zinkiodid.
- CuCl: Kupfer (I) chlorid.
- CuClzwei: Kupfer (II) chlorid.
- TiCl4: Titan (IV) chlorid oder Titantetrachlorid.
Wasserstoff und Nichtmetallelemente - sogar Halogene selbst - können jedoch auch Halogenide bilden. In diesen Fällen wird die Wertigkeit des Nichtmetalls am Ende nicht benannt:
- PCl5: Phosphorpentachlorid.
- BF3: Bortrifluorid.
- Ali3: Aluminiumtriiodid.
- HBr: Bromwasserstoff.
- WENN7: Jodheptafluorid.
Bio
Unabhängig davon, ob es sich um RX oder ArX handelt, ist Halogen kovalent an ein Kohlenstoffatom gebunden. In diesen Fällen werden Halogene mit ihren Namen erwähnt, und der Rest der Nomenklatur hängt von der Molekülstruktur von R oder Ar ab.
Für das einfachste organische Molekül ist Methan (CH4) werden die folgenden Derivate erhalten, indem Cl durch H ersetzt wird:
- CH3Cl: Chlormethan.
- CHzweiClzwei: Dichlormethan.
- CHCl3: Trichlormethan (Chloroform).
- CCl4: Tetrachlormethan (Kohlenstoff (IV) chlorid oder Tetrachlorkohlenstoff).
Hier besteht R aus einem einzelnen Kohlenstoffatom. Für andere aliphatische Ketten (linear oder verzweigt) wird also die Anzahl der Kohlenstoffe gezählt, von denen es an das Halogen gebunden ist:
CH3CHzweiCHzweiF: 1-Fluorpropan.
Das obige Beispiel war das eines primären Alkylhalogenids. Für den Fall, dass die Kette verzweigt ist, wird die längste Kette ausgewählt, die das Halogen enthält, und die Zählung beginnt, wobei die kleinstmögliche Anzahl übrig bleibt:
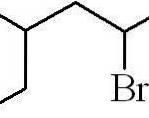
3-Methyl-5-bromhexan
Gleiches gilt für andere Substituenten. Ebenso wird für aromatische Halogenide das Halogen und dann der Rest der Struktur benannt:
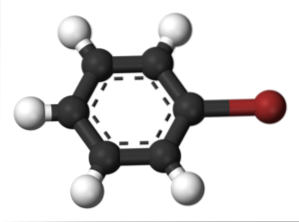
Das obere Bild zeigt die Verbindung namens Brombenzol, wobei das Bromatom braun hervorgehoben wird.
Eigenschaften
Anorganische Halogenide
Anorganische Halogenide sind ionische oder molekulare Feststoffe, obwohl erstere häufiger vorkommen. Abhängig von den Wechselwirkungen und Ionenradien von MX ist es in Wasser oder anderen weniger polaren Lösungsmitteln löslich.
Nichtmetallische Halogenide (wie Borhalogenide) sind im Allgemeinen Lewis-Säuren, was bedeutet, dass sie Elektronen aufnehmen, um Komplexe zu bilden. Andererseits erzeugen in Wasser gelöste Halogenwasserstoffe (oder Halogenide) sogenannte Hydracide..
Seine Schmelz-, Siede- oder Sublimationspunkte hängen von den elektrostatischen oder kovalenten Wechselwirkungen zwischen dem Metall oder Nichtmetall mit dem Halogen ab..
Ebenso spielen Ionenradien eine wichtige Rolle bei diesen Eigenschaften. Zum Beispiel, wenn M.+ und X.- Haben Sie ähnliche Größen, werden Ihre Kristalle stabiler.
Organische Halogenide
Sie sind polar. Warum? Weil der Unterschied in der Elektronegativität zwischen C und Halogen ein permanentes polares Moment im Molekül erzeugt. Ebenso nimmt dies ab, wenn Gruppe 17 von der CF-Bindung zu C-I abfällt.
Unabhängig von der Molekülstruktur von R oder Ar wirkt sich die zunehmende Anzahl von Halogenen direkt auf die Siedepunkte aus, da sie die Molmasse und die intermolekularen Wechselwirkungen (RC-X-X-CR) erhöhen. Die meisten sind mit Wasser nicht mischbar, können sich jedoch in organischen Lösungsmitteln lösen.
Anwendungen
Die Verwendung der halogenierten Derivate könnte ihren eigenen Text behalten. Die molekularen "Partner" von Halogenen sind ein Schlüsselfaktor, da ihre Eigenschaften und Reaktivitäten die Verwendung des Derivats bestimmen..
Unter der großen Vielfalt der Verwendungsmöglichkeiten fallen daher folgende auf:
- Molekulare Halogene werden zur Herstellung von Halogenlampen verwendet, wo sie mit dem glühenden Wolframfaden in Kontakt kommen. Der Zweck dieser Mischung besteht darin, das Halogen X mit dem verdampften Wolfram zu reagieren. Auf diese Weise wird die Ablagerung auf der Oberfläche des Kolbens vermieden, was eine längere Lebensdauer garantiert..
- Fluoridsalze werden zur Fluoridierung von Wasser und Zahnpasten verwendet.
- Natrium- und Calciumhypochlorite sind zwei Wirkstoffe in handelsüblichen Bleichlösungen (Chlor)..
- Obwohl sie die Ozonschicht schädigen, werden Fluorchlorkohlenwasserstoffe (FCKW) in Aerosolen und Kühlsystemen verwendet..
- Vinylchlorid (CHzwei= CHCl) ist das Monomer des Polyvinylchlorid (PVC) -Polymers. Andererseits besteht Teflon, das als Antihaftmaterial verwendet wird, aus Polymerketten von Tetrafluorethylen (F.zweiC = CF.zwei).
- Sie werden in der analytischen Chemie und in organischen Synthesen für verschiedene Zwecke verwendet; unter diesen die Synthese von Arzneimitteln.
Zusätzliche Beispiele
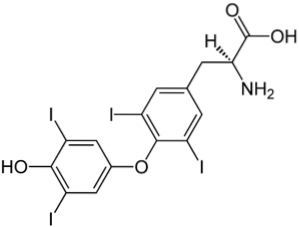
Das obere Bild zeigt das Schilddrüsenhormon, das für die Wärmeerzeugung sowie die Steigerung des allgemeinen Stoffwechsels im Körper verantwortlich ist. Diese Verbindung ist ein Beispiel für ein halogeniertes Derivat, das im menschlichen Körper vorhanden ist.
Unter anderen halogenierten Verbindungen werden die folgenden erwähnt:
- Dichlordiphenyltrichlorethan (DDT), wirksames Insektizid, jedoch mit schwerwiegenden Umweltauswirkungen.
- Zinnchlorid (SnClzwei) als Reduktionsmittel verwendet.
- Chlorethan oder 1-Chlorethan (CH3CHzweiCl), ein topisches Anästhetikum, das durch Abkühlen der Haut schnell wirkt.
- Dichlorethylen (ClCH = CClH) und Tetrachlorethylen (ClzweiC = CClzwei), als Lösungsmittel in der chemischen Reinigungsindustrie verwendet.
Verweise
- Dr. Ian Hunt. Grundlegende organische IUPAC-NomenklaturHaloalkane / Alkylhalogenide. Abgerufen am 04. Mai 2018 von: chem.ucalgary.ca
- Richard C. Banks. (August 2000). Nomenklatur der organischen Halogenide. Abgerufen am 04. Mai 2018 von: chemistry.boisestate.edu
- Advameg, Inc. (2018). Organische Halogenverbindungen. Abgerufen am 4. Mai 2018 von: chemistryexplained.com
- Organische Halogenverbindungen. Abgerufen am 04. Mai 2018 von: 4college.co.uk
- Dr. Seham Alterary. (2014). Organische Halogenverbindungen. Abgerufen am 04. Mai 2018 von: fac.ksu.edu.sa
- Clark J. Physikalische Eigenschaften von Alkylhalogeniden. Abgerufen am 04. Mai 2018 von: chem.libretexts.org
- Dr. Manal K. Rasheed. Organische Halogenide. Abgerufen am 4. Mai 2018 von: komed.uobaghdad.edu.iq

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.