
Chemische Kinetikfaktoren, Reaktionsreihenfolge und Anwendungen
Das chemische Kinetik Es ist die Untersuchung der Reaktionsgeschwindigkeiten. Leiten Sie experimentelle oder theoretische Daten zum molekularen Mechanismus durch Gesetze ab, die durch mathematische Gleichungen ausgedrückt werden. Mechanismen bestehen aus einer Reihe von Schritten, von denen einige schnell und einige langsam sind..
Der langsamste davon wird als Geschwindigkeitsbestimmungsschritt bezeichnet. Daher ist es kinetisch sehr wichtig, die intermediären Spezies und den Funktionsmechanismus dieses Schritts zu kennen. Eine Visualisierung des Obigen besteht darin, anzunehmen, dass die Reagenzien in einer Flasche eingeschlossen sind und dass die Produkte bei der Reaktion nach außen entweichen.

Schließlich treten die Produkte ohne weitere kinetische Hindernisse frei aus dem Flaschenhals aus. Aus dieser Perspektive gibt es Flaschen in vielen Größen und Designs. Allen gemeinsam ist jedoch ein Element: ein schmaler Hals, ein Indikator für den entscheidenden Reaktionsschritt..
Artikelverzeichnis
- 1 Was untersucht die chemische Kinetik??
- 2 Reaktionsgeschwindigkeit
- 2.1 Definition
- 2.2 Allgemeine Gleichung
- 2.3 Dessertbeispiel
- 2.4 Wie man es bestimmt
- 3 Faktoren, die die Reaktionsgeschwindigkeit beeinflussen
- 3.1 Art der chemischen Spezies
- 3.2 Konzentration der Reagenzien
- 3.3 Temperatur
- 4 Reaktionsreihenfolge in der chemischen Kinetik
- 4.1 Reaktionen nullter Ordnung
- 4.2 Reaktion erster Ordnung
- 4.3 Reaktion zweiter Ordnung
- 4.4 Reaktionsreihenfolge gegen Molekularität
- 5 Anwendungen
- 6 Referenzen
Was untersucht die chemische Kinetik??
Experimentell untersucht dieser Zweig der Chemie die Konzentrationsschwankungen, die an einer chemischen Reaktion beteiligt sind, anhand der Messung einer bestimmten Eigenschaft.
Die chemische Kinetik ist der Zweig der Chemie, der für die Untersuchung aller Informationen zuständig ist, die aus der Geschwindigkeit einer Reaktion abgeleitet werden können. Sein Name lädt Sie ein, sich eine Taschenuhr vorzustellen, die die Zeit eines Prozesses markiert, egal wo er stattfindet: in einem Reaktor, in einer Wolke, in einem Fluss, im menschlichen Körper usw..
Alle chemischen Reaktionen und damit alle Transformationen haben thermodynamische, Gleichgewichts- und kinetische Aspekte. Die Thermodynamik zeigt an, ob eine Reaktion spontan ist oder nicht. das Gleichgewicht seinen Quantifizierungsgrad; und Kinetik die Bedingungen, die seine Geschwindigkeit begünstigen, sowie die Daten über seinen Mechanismus.
Viele der wesentlichen Aspekte der chemischen Kinetik können im täglichen Leben beobachtet werden: im Kühlschrank, der Lebensmittel einfriert, um ihre Zersetzung durch Einfrieren des darin enthaltenen Wassers zu verringern. Auch bei der Reifung der Weine, deren Alterung ihm seine angenehmen Aromen verleiht.
"Die Zeit der Moleküle" ist jedoch in ihren winzigen Maßstäben sehr unterschiedlich und variiert enorm in Abhängigkeit von vielen Faktoren (Anzahl und Art der Bindungen, Größen, Materiezustände usw.)..
Da Zeit Leben und auch Geld ist, ist es von größter Bedeutung zu wissen, welche Variablen es ermöglichen, dass eine chemische Reaktion so schnell wie möglich abläuft. Manchmal ist jedoch das Gegenteil erwünscht: Die Reaktion läuft sehr langsam ab, insbesondere wenn sie exotherm ist und Explosionsgefahr besteht.
Was sind diese Variablen? Einige sind physikalisch, beispielsweise bei welchem Druck oder welcher Temperatur sollte ein Reaktor oder ein System haben; und andere sind chemisch, wie die Art des Lösungsmittels, der pH-Wert, der Salzgehalt, die Molekülstruktur usw..
Bevor wir diese Variablen finden, müssen wir jedoch zuerst die Kinetik der vorliegenden Reaktion untersuchen.
Wie? Durch die Variation der Konzentration, die verfolgt werden kann, wenn eine bestimmte Eigenschaft, die proportional zur ersten ist, quantifiziert wird. Im Laufe der Geschichte sind die Methoden immer ausgefeilter geworden und ermöglichen genauere und präzisere Messungen mit immer kürzeren Intervallen..
Reaktionsgeschwindigkeit
Um die Geschwindigkeit einer chemischen Reaktion zu bestimmen, muss bekannt sein, wie sich die Konzentration einer der beteiligten Spezies über die Zeit ändert. Diese Geschwindigkeit hängt in hohem Maße von vielen Faktoren ab, aber das Wichtigste ist, dass sie für diejenigen Reaktionen messbar ist, die "langsam" ablaufen..
Hier ist das Wort "langsam" relativ und wird für alles definiert, was mit den verfügbaren Instrumententechniken gemessen werden kann. Wenn zum Beispiel die Reaktion viel schneller ist als die Messkapazität des Geräts, ist sie weder quantitativ noch kann ihre Kinetik untersucht werden..
Dann wird die Reaktionsgeschwindigkeit an der Schwelle eines Prozesses bestimmt, bevor er das Gleichgewicht erreicht. Warum? Denn im Gleichgewicht sind die Geschwindigkeit der Vorwärtsreaktion (Produktbildung) und die der Rückwärtsreaktion (Reaktantenbildung) gleich.
Durch Steuern der auf das System einwirkenden Variablen und folglich seiner Kinetik oder der Reaktionsgeschwindigkeit können die idealen Bedingungen ausgewählt werden, um eine bestimmte Menge an Produkt in der am meisten gewünschten und sicheren Zeit zu erzeugen..
Andererseits enthüllt dieses Wissen den molekularen Mechanismus, der wertvoll ist, wenn die Ausbeute einer Reaktion erhöht wird..
Definition
Geschwindigkeit ist die Änderung einer Größe als Funktion der Zeit. Für diese Studien liegt das Interesse darin, die Variation der Konzentration im Laufe der Stunden und Minuten zu bestimmen; Nano-, Pico- oder sogar Femtosekunden (10-fünfzehns).
Sie können viele Einheiten haben, aber die einfachste und einfachste von allen ist M s-1, oder was ist gleich mol / L · s. Unabhängig von seinen Einheiten sollte es immer einen positiven Wert haben, da es sich um eine physikalische Größe handelt (z. B. Abmessungen oder Masse)..
Konventionell haben jedoch die Verschwindungsraten für einen Reaktanten ein negatives Vorzeichen und die Erscheinungsraten für ein Produkt ein positives Vorzeichen..
Aber wenn die Reaktanten und Produkte ihre eigenen Geschwindigkeiten haben, wie kann dann die Gesamtreaktionsrate bestimmt werden? Die Antwort liegt in den stöchiometrischen Koeffizienten.
Allgemeine Gleichung
Die folgende chemische Gleichung drückt die Reaktion von A und B unter Bildung von C und D aus:
zuZU + bB => cC. + dD.
Molare Konzentrationen werden normalerweise in eckigen Klammern angegeben, so dass beispielsweise die Konzentration der Spezies A als [A] geschrieben wird. Somit beträgt die Reaktionsgeschwindigkeit für jede der beteiligten chemischen Spezies:
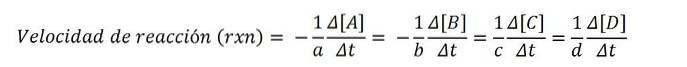
Nach der mathematischen Gleichung gibt es vier Wege, um die Reaktionsgeschwindigkeit zu erreichen: Die Variation der Konzentration eines der Reaktanten (A oder B) oder der Produkte (C oder D) wird gemessen..
Teilen Sie dann mit einem dieser Werte und seinem korrekten stöchiometrischen Koeffizienten durch diesen und erhalten Sie die Reaktionsgeschwindigkeit rxn.
Da die Reaktionsgeschwindigkeit eine positive Größe ist, multipliziert das negative Vorzeichen die negativen Geschwindigkeitswerte der Reaktanten; aus diesem Grund die Koeffizienten zu Y. b multiplizieren mit (-1).
Zum Beispiel, wenn die Verschwindungsrate von A - (5 M / s) und sein stöchiometrischer Koeffizient beträgt zu ist 2, also ist die Geschwindigkeit rxn gleich 2,5 M / s ((-1/2) x 5).
Dessert Beispiel

Wenn das Produkt ein Dessert wäre, wären die Zutaten analog die Reagenzien; und die chemische Gleichung, das Rezept:
7Kekse + 3 Brownies + 1 Eis => 1 Dessert
Und die Geschwindigkeiten für jede der süßen Zutaten und für das Dessert selbst sind:
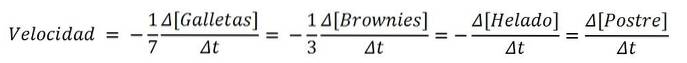
Somit kann die Geschwindigkeit, mit der das Dessert hergestellt wird, entweder durch Variation der Kekse, der Brownies, des Eises oder des Sets selbst bestimmt werden. dann dividiere es durch seine stöchiometrischen Koeffizienten (7, 3, 1 und 1). Eine der Routen kann jedoch einfacher sein als die andere..
Wenn Sie beispielsweise messen, wie [Dessert] in verschiedenen Zeitintervallen steigt, können diese Messungen schwierig sein..
Andererseits kann es aufgrund ihrer Anzahl oder einiger ihrer Eigenschaften, die eine leichtere Bestimmung ihrer Konzentration als die von Brownies oder Eiscreme ermöglichen, bequemer und praktischer sein, [Cookies] zu messen..
Wie man es bestimmt
Wenn bei der einfachen Reaktion A => B beispielsweise A in wässriger Lösung eine grüne Färbung aufweist, hängt dies von seiner Konzentration ab. Wenn also A zu B wird, verschwindet die grüne Farbe, und wenn dieses Verschwinden quantifiziert wird, kann eine Kurve von [A] gegen t erhalten werden.
Wenn andererseits B eine saure Spezies ist, fällt der pH-Wert der Lösung auf Werte unter 7 ab. Somit erhalten wir aus der Abnahme des pH-Werts [B] und nacheinander den Graphen [B] gegen t. Wenn wir dann beide Graphen überlagern, sehen wir ungefähr Folgendes:

In der Grafik können wir sehen, wie [A] mit der Zeit abnimmt, weil es verbraucht wird, und wie die Kurve [B] mit einer positiven Steigung zunimmt, weil es das Produkt ist.
Es ist auch ersichtlich, dass [A] gegen Null tendiert (wenn kein Gleichgewicht besteht) und dass [B] einen durch Stöchiometrie bestimmten Maximalwert erreicht und wenn die Reaktion abgeschlossen ist (alles A wird verbraucht).
Die Reaktionsgeschwindigkeit von A und B ist die Tangentenlinie auf einer dieser Kurven; mit anderen Worten, die Ableitung.
Faktoren, die die Reaktionsgeschwindigkeit beeinflussen
Art der chemischen Spezies
Wenn alle chemischen Reaktionen augenblicklich wären, würden ihre kinetischen Studien nicht existieren. Viele haben Geschwindigkeiten, die so hoch sind, dass sie nicht gemessen werden können. das heißt, sie sind nicht messbar.
Daher sind die Reaktionen zwischen den Ionen normalerweise sehr schnell und vollständig (mit einer Ausbeute um 100%). Andererseits benötigen diejenigen, an denen organische Verbindungen beteiligt sind, einige Zeit. Eine Reaktion des ersten Typs ist:
H.zweiSW4 + 2NaOH => NazweiSW4 + 2HzweiODER
Die starken elektrostatischen Wechselwirkungen zwischen den Ionen begünstigen die schnelle Bildung von Wasser und Natriumsulfat. Stattdessen ist eine Reaktion des zweiten Typs beispielsweise die Veresterung von Essigsäure:
CH3COOH + CH3CHzweiOH => CH3COOCHzweiCH3 + H.zweiODER
Obwohl auch Wasser gebildet wird, ist die Reaktion nicht augenblicklich; Selbst unter günstigen Bedingungen dauert die Fertigstellung mehrere Stunden.
Andere Variablen haben jedoch einen größeren Einfluss auf die Reaktionsgeschwindigkeit: Konzentration der Reaktanten, Temperatur, Druck und Anwesenheit von Katalysatoren..
Reagenzienkonzentration
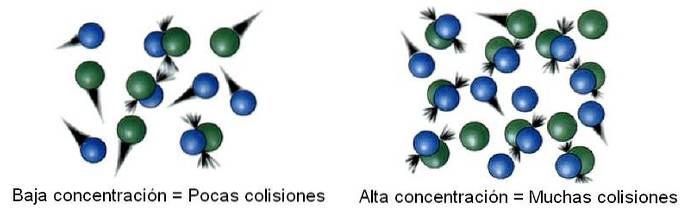
In der chemischen Kinetik wird der untersuchte Raum, der von der Unendlichkeit getrennt ist, als System bezeichnet. Beispielsweise kann ein Reaktor, ein Becher, ein Kolben, eine Wolke, ein Stern usw. als das untersuchte System betrachtet werden..
Innerhalb des Systems sind die Moleküle also nicht statisch, sondern "wandern" zu allen Ecken. Bei einigen dieser Verschiebungen kollidiert es mit einem anderen Molekül, um zurückzuspringen oder Produkte zu produzieren..
Dann ist die Anzahl der Kollisionen proportional zur Konzentration der Reaktanten. Das obige Bild zeigt, wie sich das System von niedrigen zu hohen Konzentrationen ändert.
Je mehr Kollisionen es gibt, desto schneller ist auch die Reaktionsgeschwindigkeit, da die Wahrscheinlichkeit, dass zwei Moleküle reagieren, zunimmt..
Wenn die Reaktanten gasförmig sind, wird die Druckvariable behandelt und hängt von der Gaskonzentration ab, wobei eine der vielen vorhandenen Gleichungen (wie die des idealen Gases) angenommen wird. oder auch das Volumen des Systems wird verringert, um die Wahrscheinlichkeit zu erhöhen, dass die gasförmigen Moleküle kollidieren.
Temperatur
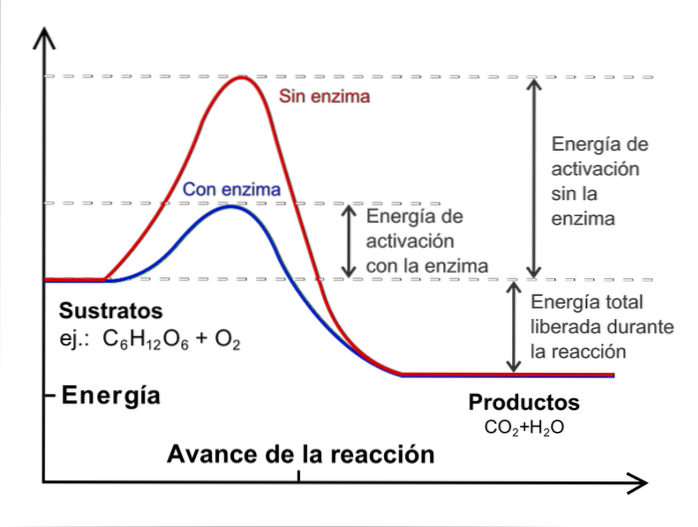
Obwohl die Anzahl der Kollisionen zunimmt, haben nicht alle Moleküle die Energie, die erforderlich ist, um die Aktivierungsenergie des Prozesses zu überschreiten.
Hier spielt die Temperatur eine wichtige Rolle: Sie hat die Funktion, die Moleküle thermisch zu beschleunigen, damit sie mit mehr Energie kollidieren..
Somit verdoppelt sich die Reaktionsgeschwindigkeit im Allgemeinen mit jedem Anstieg der Systemtemperatur um 10 ° C. Dies ist jedoch nicht bei allen Reaktionen der Fall. Wie kann man diesen Anstieg vorhersagen? Die Arrhenius-Gleichung beantwortet die Frage:
d (lnK) / dT = E / (RTzwei)
K ist die Geschwindigkeitskonstante bei der Temperatur T, R ist die Gaskonstante und E ist die Aktivierungsenergie. Diese Energie zeigt die Energiebarriere an, die die Reaktanten skalieren müssen, um zu reagieren..
Um eine kinetische Untersuchung durchzuführen, ist es notwendig, die Temperatur konstant und ohne Katalysatoren zu halten. Was sind Katalysatoren? Sie sind externe Spezies, die in die Reaktion eingreifen, aber nicht verbraucht werden und die Aktivierungsenergie verringern.
Das obige Bild zeigt das Konzept der Katalyse für die Reaktion von Glucose mit Sauerstoff. Die rote Linie repräsentiert die Aktivierungsenergie ohne das Enzym (biologischer Katalysator), während die blaue Linie eine Abnahme der Aktivierungsenergie zeigt.
Reaktionsreihenfolge in der chemischen Kinetik
In einer chemischen Gleichung sind die stöchiometrischen Indizes, die sich auf den Reaktionsmechanismus beziehen, nicht gleich den Indizes derselben Ordnung. Chemische Reaktionen haben normalerweise eine erste oder zweite Ordnung, selten eine dritte Ordnung oder höher..
Für was ist das? Weil die Kollisionen von drei energetisch angeregten Molekülen unwahrscheinlich sind, und noch mehr Vierfach- oder Fünffachkollisionen, bei denen die Wahrscheinlichkeit infinitesimal ist. Bruchreaktionsordnungen sind ebenfalls möglich. Beispielsweise:
NH4Cl <=>NH3 + HCl
Die Reaktion ist in einem Sinne erster Ordnung (von links nach rechts) und in dem anderen Sinne zweiter Ordnung (von rechts nach links), wenn sie als Gleichgewicht betrachtet wird. Während das folgende Gleichgewicht in beide Richtungen zweiter Ordnung ist:
2HI <=> H.zwei + ichzwei
Sind Molekularität und Reaktionsreihenfolge gleich? Nein. Die Molekularität ist die Anzahl der Moleküle, die reagieren, um Produkte hervorzubringen, und die Gesamtreaktionsreihenfolge ist die gleiche Reihenfolge der Reaktanten, die an dem Bestimmungsgeschwindigkeitsschritt beteiligt sind..
2KMnO4 + 10KI + 8HzweiSW4 => 2MnSO4 + 5Izwei + 6KzweiSW4 + 8HzweiODER
Diese Reaktion ist trotz hoher stöchiometrischer Indizes (Molekularität) tatsächlich eine Reaktion zweiter Ordnung. Mit anderen Worten ist der Bestimmungsschritt der Geschwindigkeit von zweiter Ordnung.
Reaktionen nullter Ordnung
Sie treten bei heterogenen Reaktionen auf. Zum Beispiel: zwischen einer Flüssigkeit und einem Feststoff. Somit ist die Geschwindigkeit unabhängig von den Konzentrationen der Reaktanten.
Wenn ein Reaktant eine Reaktionsordnung von Null hat, bedeutet dies ebenfalls, dass er nicht am Bestimmungsschritt der Geschwindigkeit teilnimmt, sondern am schnellen.
Reaktion erster Ordnung
A => B.
Eine Reaktion erster Ordnung unterliegt dem folgenden Geschwindigkeitsgesetz:
V = k [A]
Wenn sich die Konzentration von A verdoppelt, verdoppelt sich die Reaktionsgeschwindigkeit V. Daher ist die Geschwindigkeit proportional zur Konzentration des Reagens im Bestimmungsschritt der Reaktion..
Reaktion zweiter Ordnung
2A => B.
A + B => C.
Zwei Arten sind an dieser Art von Reaktion beteiligt, genau wie in den beiden gerade geschriebenen chemischen Gleichungen. Die Geschwindigkeitsgesetze für die Reaktionen sind:
V = k [A]zwei
V = k [A] [B]
Im ersten Fall ist die Reaktionsgeschwindigkeit proportional zum Quadrat der Konzentration von A, während im zweiten Fall dasselbe wie bei den Reaktionen erster Ordnung auftritt: Die Geschwindigkeit ist direkt proportional zu den Konzentrationen von A und B..
Reaktionsreihenfolge gegen Molekularität
Gemäß dem vorherigen Beispiel können die stöchiometrischen Koeffizienten mit den Ordnungen der Reaktion übereinstimmen oder nicht.
Dies geschieht jedoch für Elementarreaktionen, die den molekularen Mechanismus eines Reaktionsschritts bestimmen. Bei diesen Reaktionen sind die Koeffizienten gleich der Anzahl der beteiligten Moleküle.
Zum Beispiel reagiert ein Molekül von A mit einem von B, um ein Molekül von C zu bilden. Hier ist die Molekularität 1 für die Reaktanten und dann stimmen sie im Ausdruck des Geschwindigkeitsgesetzes mit den Reaktionsordnungen überein.
Daraus folgt, dass die Molekularität immer eine ganze Zahl und wahrscheinlich weniger als vier sein muss.
Warum? Weil es beim Durchgang eines Mechanismus sehr unwahrscheinlich ist, dass vier Moleküle gleichzeitig beteiligt sind; zwei von ihnen könnten zuerst reagieren, und dann würden die verbleibenden zwei mit diesem Produkt reagieren.
Mathematisch ist dies einer der Hauptunterschiede zwischen Reaktionsreihenfolge und Molekularität: Eine Reaktionsreihenfolge kann Bruchwerte annehmen (1/2, 5/2 usw.)..
Dies liegt daran, dass erstere nur widerspiegeln, wie sich die Konzentration der Spezies auf die Geschwindigkeit auswirkt, nicht jedoch, wie ihre Moleküle in den Prozess eingreifen..
Anwendungen
- Es ermöglicht die Bestimmung der Zeit, die ein Medikament im Körper verbleibt, bevor es vollständig metabolisiert wird. Ebenso kann dank kinetischer Studien die enzymatische Katalyse als umweltfreundliche Methode im Vergleich zu anderen Katalysatoren mit negativen Umweltauswirkungen verfolgt werden. oder auch in unzähligen industriellen Prozessen eingesetzt werden.
- In der Automobilindustrie, insbesondere in Motoren, wo elektrochemische Reaktionen schnell durchgeführt werden müssen, damit das Fahrzeug startet. Auch in seinen Auspuffrohren, die Katalysatoren haben, um die schädlichen Gase CO, NO und NO umzuwandeln.x in COzwei, H.zweiAUFzwei michzwei während der optimalen Zeit.
2NaN3(s) = 2Na (s) + 3Nzwei(G)
-Es ist die Reaktion dahinter, warum sich Airbags, die "Airbags", aufblasen, wenn Fahrzeuge kollidieren. Wenn die Reifen auf die Bremse treten, detoniert ein Detektor das Natriumazid NaN elektrisch3. Dieses Reagenz "explodiert" unter Freisetzung von N.zwei, das nimmt schnell das gesamte Volumen des Beutels ein.
Metallisches Natrium reagiert dann mit anderen Komponenten, um es zu neutralisieren, da es in seinem reinen Zustand giftig ist.
Verweise
- Walter J. Moore. (1963). Physikalische Chemie. Im Chemische Kinetik. Vierte Ausgabe, Longmans.
- Ira N. Levine. (2009). Prinzipien der Physikochemie. Sechste Ausgabe, S. 479-540. Mc Graw Hill.
- UAwiki. (23. Dezember 2011). Molekülkollisionen-ist. [Zahl]. Abgerufen am 30. April 2018 von: es.m.wikipedia.org
- Glasstone. (1970). Lehrbuch der physikalischen Chemie. Im Chemische Kinetik. Zweite Ausgabe. D. Van Nostrand, Company, Inc..
- Anne Marie Helmenstine, Ph.D. (8. März 2017). Definition der chemischen Kinetik. Abgerufen am 30. April 2018 von :oughtco.com
- Khan Akademie. (2018). Reaktionsraten und Ratengesetze. Abgerufen am 30. April 2018 von: khanacademy.org
- Germán Fernández. (26. Juli 2010). Chemische Kinetik. Abgerufen am 30. April 2018 von: quimicafisica.com
Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.