
Struktur, Eigenschaften, Verwendungen von Natriumdodecylsulfat (SDS)
Das Natriumdodecylsulfat (SDS) ist ein anionisches, synthetisches und amphiphiles organisches Salz. Der unpolare und hydrophobe Teil entspricht der Kohlenwasserstoffkette; während der polare und hydrophile Teil auf Sulfat mit einer negativen Ladung zurückzuführen ist.
SDS ist ein Tensid: Seine Moleküle werden auf der Oberfläche wässriger Lösungen platziert, wodurch die Oberflächenspannung abnimmt. Diese Funktion ermöglicht die Verwendung in Shampoo, Zahnpasten, Seifen und anderen Körperpflege- und Haushaltsreinigungsmitteln..
Natriumdodecylsulfat bindet an das Protein und erzeugt dessen Entfaltung, wobei es eine längliche Form annimmt. Die Sulfatgruppen sind Wasser ausgesetzt und erhalten negative Ladungen, deren Anzahl proportional zu ihrem Molekulargewicht ist..
Aus diesem Grund ermöglicht SDS die Bestimmung des Molekulargewichts von Proteinen durch Polyacrylamidelektrophorese..
Obwohl eine mögliche krebserzeugende Wirkung von SDS vermutet wurde, wurde dies nicht eindeutig nachgewiesen. Sicherheitsdatenblätter können wie andere Reinigungsmittel Haut- und Augenreizungen verursachen..
Artikelverzeichnis
- 1 Aufbau des Sicherheitsdatenblatts
- 1.1 Kristalle
- 1.2 Mizellen
- 2 Eigenschaften
- 2.1 Namen
- 2.2 Summenformel
- 2,3 Molmasse
- 2.4 Physikalische Beschreibung
- 2.5 Geruch
- 2.6 Schmelzpunkt
- 2.7 Löslichkeit in Wasser
- 2.8 Dichte
- 2.9 Stabilität
- 2.10 Zersetzung
- 2.11 Oberflächenspannung
- 2.12 Kritische molare Konzentration
- 3 Verwendungen
- 3.1 Körperpflege und Reinigung zu Hause
- 3.2 Veterinär- und Humanmedizin
- 3.3 Im Labor
- 3.4 Lebensmittelzusatzstoff
- 3.5 Industrie
- 4 Risiken
- 5 Referenzen
Struktur des Sicherheitsdatenblatts
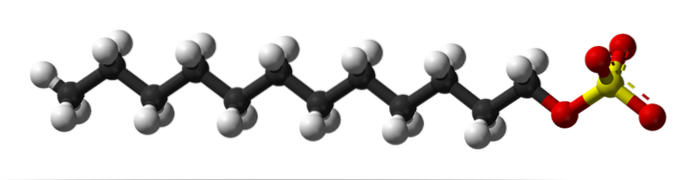
Im ersten Bild wurde das SDS-Molekül mit einem Kugel- und Stabmodell gezeigt. Wie zu sehen ist, hat es einen hydrophoben und unpolaren kohlensäurehaltigen Schwanz (schwarze und weiße Kugeln); und gleichzeitig ein Polarkopf dank der Anwesenheit der Gruppe -SO4- (gelbe und rote Kugeln).
Obwohl nicht gezeigt, sollte es eine violette Kugel geben, die das Na-Kation darstellt+, direkt neben der -SO-Gruppe4-, elektrostatisch interagieren.
Das heißt, es ist leicht zu erkennen, warum diese Verbindung amphiphil ist; und auch ein anionisches Tensid, da die Ladung von SDS negativ ist und zusätzlich zu Na andere Kationen anziehen kann+.
Das Molekül vermittelt den falschen Eindruck, starr zu sein, eine unbewegliche lineare Struktur. Es ist jedoch genau das Gegenteil. Das Sicherheitsdatenblatt könnte mit einem "Wurm" verglichen werden, dessen kohlensäurehaltiger Schwanz mehrere Schwingungen und Rotationen seiner Einfachbindungen aufweist. Dies macht es in der Lage, verschiedene Formen oder Falten in der Mitte anzunehmen; zum Beispiel in Wasser.
Kristalle
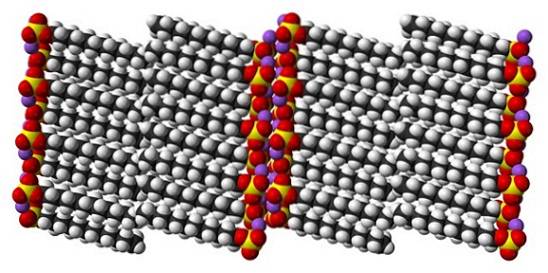
Obwohl Natriumdodecylsulfat ein dynamisches Molekül ist, muss es sich im festen Zustand nicht zu stark bewegen und verhält sich wie ein "einfacher" Stab. Und so ist jedes Molekül oder jeder Balken so positioniert, dass die Wechselwirkungen zwischen den Carbonatschwänzen und gleichzeitig denen ihrer Ionenladungen verstärkt werden..
Das Ergebnis ist die Bildung eines monoklinen Kristalls, in dem die SDS-Moleküle in mehrere Balkensäulen gepackt sind (oberes Bild). Die intermolekularen Kräfte, die sie binden, sind derart, dass diese Kristalle eine Temperatur von 206ºC benötigen, um in die flüssige Phase zu schmelzen..
Mizellen
Außerhalb des Komforts seiner Kristalle kann das SDS-Molekül nicht mehr still sitzen. beginnt, seinen Schwanz zu drehen, um die Wechselwirkungen mit der äußeren Umgebung zu erhöhen oder zu verringern.
Wenn dieses Medium Wasser ist, tritt ein Phänomen auf, das als Mizellenbildung bezeichnet wird: Die kohlensäurehaltigen und hydrophoben Schwänze verbinden sich, um sich zu bewaffnen, während die Polköpfe die -SO-Gruppen bilden4-, bleiben auf der Oberfläche und interagieren mit H-MolekülenzweiODER.
Die Mizelle nimmt dann eine abgeflachte Ellipsoidmorphologie an (wie die Erde, jedoch abgeflachter). Im Glas sind sie als Balkenblöcke und in einem wässrigen Medium als Ellipsoidmizellen. Was wäre, wenn das Medium ölig wäre? Die Mizelle wäre umgekehrt: die Polköpfe SO4- würde zum Kern gehen, während ihre kohlensäurehaltigen Schwänze dem Öl ausgesetzt wären.
Eigenschaften
Namen
- Natriumdodecylsulfat (SDS).
- Natriumlaurylsulfat (SLS).
Molekularformel
C.12H.25ODER4SNa.
Molmasse
288,378 g / mol.
Physische Beschreibung
Verschiedene Präsentationen: trockenes Pulver, flüssiger oder nasser Feststoff. Seine Kristalle haben eine weiße oder cremige Farbe.
Geruch
Schwacher Geruch von Fettstoffen, geruchlos.
Schmelzpunkt
206 ºC.
Wasserlöslichkeit
1 105 mg / l. 1 g gelöst in 10 ml einer opaleszierenden Lösung.
Dichte
1,01 g / cm3.
Stabilität
Stabil unter empfohlenen Lagerbedingungen.
Zersetzung
Beim Erhitzen zur Zersetzung entsteht ein weißer Rauch aus Schwefeloxid und Natriumoxid.
Oberflächenspannung
39,5 Dyn / cm bei 25 ° C..
Kritische molare Konzentration
Es ist 8,2 mM in reinem Wasser bei 25 ºC.
Anwendungen
Körperpflege und Reinigung zu Hause
Dodecylsulfat ist ein Tensid, das in vielen Produkten wie Handseifen, Schaumbädern, Rasiercremes usw. verwendet wird. Es wird auch verwendet, um schwer zu entfernende Flecken von Kleidung zu entfernen, Böden und Badezimmer zu reinigen, Küchenutensilien zu schrubben usw..
Veterinär- und Humanmedizin
Es wird als Abwehrmittel gegen Flöhe und Zecken verwendet, die bei Tieren vorkommen. Es wird auch als Feuchthaltemittel in einigen Antibiotika zur oralen oder topischen Anwendung verwendet..
SDS ist mikrobizid gegen umhüllte Viren wie HIV, Typ 1 und 2 und das Herpes-simplex-Virus (HSV-2). Es wirkt auch auf nicht umhüllte Viren: Papillomavirus, Reovirus, Rotavirus und Poliovirus. Diese Verwendung ist jedoch nicht zugelassen..
Die Verwendung von Sicherheitsdatenblättern als Dusche wurde vorgeschlagen, um Schutz vor sexuell übertragbaren Viren zu bieten. Auch bei der Verarbeitung von Muttermilch, um die Möglichkeit einer HIV-Übertragung über das Stillen auszuschließen oder zu verringern.
Zusätzlich zu seiner antiviralen Wirkung wirkt SDS auf pathogene Bakterien und Pilze. SDS entfernt Arzneimittelresistenz- und Geschlechtsübertragungsfaktoren aus E. coli; und blockiert das Wachstum zahlreicher grampositiver Bakterien.
Im Labor
SDS bindet an Proteine, verursacht deren Denaturierung und versorgt sie mit negativen Ladungen und einer Konformationsänderung. Dies ermöglicht die Bestimmung ihrer Molekulargewichte durch Polyacrylamidelektrophorese..
SDS wird auch zur Herstellung von Hirngewebeproben zur Verwendung in der Lichtmikroskopie verwendet. Es wird auch bei der Vorbereitung von Blutproben zur Zählung der Anzahl der Erythrozyten verwendet..
SDS wird aufgrund seiner Fähigkeit, Membranen aufzulösen, und seiner hemmenden Wirkung auf die Aktivität von RNase- und DNase-Enzymen bei der Reinigung von Nukleinsäuren verwendet.
Darüber hinaus wird SDS zur Charakterisierung von quaternären Ammoniumverbindungen verwendet..
Lebensmittelzusatzstoff
SDS wird als Emulgator und Verdickungsmittel in Lebensmitteln verwendet. Verbessert die Stabilität und Textur von Backwaren. Zusätzlich wird es als Hilfsmittel beim Schlagen von trockenen Eiprodukten verwendet..
Industrie
SDS wird in der Galvanikindustrie verwendet, insbesondere in Nickel und Zink. als Emulgator und Eindringmittel in Lack- und Farbentferner; bei der Formulierung von spritzgegossenen Sprengstoffen; und in Feststoffraketentreibstoffen als Schaummittel.
Risiken
Ständige Exposition gegenüber SDS kann bei Meerschweinchen zu Hauthyperplasie führen. Kaninchen und Menschen sind weniger anfällig für diese Verletzungen. Direkter Kontakt mit SDS in einer Konzentration von ≤ 20% kann zu mäßigen Entzündungen und Hautreizungen führen.
Andererseits kann eine längere Exposition gegenüber SDS Dermatitis mit Anzeichen von Rötung, Schwellung und Blasenbildung verursachen..
Sicherheitsdatenblätter können bei Kontakt Augenreizungen verursachen. Bei manchen Menschen kann es auch sehr reaktiv sein und durch Einatmen Reizungen der Atemwege und Atemnot verursachen..
In seltenen Fällen kann die Einnahme von Sicherheitsdatenblättern zu ätzenden Verletzungen führen. Es wurde jedoch bei Kindern berichtet, die SDS aufgenommen haben und schnell starkes Erbrechen, ZNS-Depression und Atemnot entwickeln..
In SDS wurden keine Hinweise auf Genotoxizität oder teratogene Wirkung gefunden. Bei 242 Patienten mit ekzematöser Dermatitis wurde bei 6,4% der Patienten eine Allergie festgestellt, die auf die Verwendung des Sicherheitsdatenblatts zurückzuführen war.
Verweise
- Strukturdaten von L.A. Smith, R.B. Hammond, K.J. Roberts, D. Machin, G. McLeod (2000). Bestimmung der Kristallstruktur von wasserfreiem Natriumdodecylsulfat unter Verwendung einer Kombination aus Pulverbeugung mit Synchrotronstrahlung und molekularen Modellierungstechniken. Journal of Molecular Structure 554 (2-3): 173 & ndash; 182. DOI: 10.1016 / S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Natriumdodecylsulfat. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Natriumdodecylsulfat. PubChem-Datenbank. CID = 3423265. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Hammouda B. (2013). Temperatureffekt auf die Nanostruktur von SDS-Mizellen in Wasser. Journal of Research des Nationalen Instituts für Standards und Technologie, 118, 151-167. doi: 10.6028 / jres.118.008
- Elsevier. (2019). Natriumdodecylsulfat. Science Direct. Wiederhergestellt von: sciencedirect.com
- Kumar, S., Thejasenuo, J. K. und Tsipila, T. (2014). Toxikologische Wirkungen von Natriumdodecylsulfat. Journal of Chemical and Pharmaceutical Research 6 (5): 1488-1492.
- Toxikologisches Datennetz. (s.f.). Natriumlaurylsulfat. Toxnet. Wiederhergestellt von: toxnet.nlm.nih.gov



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.