
Starke und schwache Säuren und Basen

Eine Klassifizierung von Säuren und Basen in der Chemie hängt von der Ionisationskraft dieser Substanzen in wässrigem Medium ab. A) Ja:
- ein Säure und Base sind stark Wenn sie vollständig ionisiert sind, dh während des Ionisationsprozesses, werden sie vollständig in Kationen oder positive Ionen und in Anionen oder negative Ionen umgewandelt.
- Andererseits, Eine Säure und eine Base sind schwach Wenn sie in Wasser teilweise ionisiert sind, dh in Lösung, gibt es einen Anteil an Kationen, einen weiteren Anteil an Anionen und einen weiteren Anteil an nicht dissoziierten Molekülen.
| Starke Säuren und Basen | Schwache Säuren und Basen | |
|---|---|---|
| Definition | Substanzen, die in Lösung vollständig ionisieren. | Substanzen, die in Lösung teilweise ionisieren. |
| Ionisation | Komplett | Teilweise |
| Elemente in wässriger Lösung | Kationen und Anionen in gleicher Konzentration. | Kationen, Anionen und Moleküle in unterschiedlichen Anteilen. |
| Ionisationskonstante | Erhöht | Wenig |
| Beispiele |
|
|
Starke Säuren und Basen
EIN Säure oder Base sind stark, wenn sie in einem wässrigen Medium vollständig dissoziieren, Das heißt, der Ionisationsprozess ist abgeschlossen und die Lösung hat die gleiche Konzentration an Anionen wie Kationen.
Wie ionisiert man eine Säure und eine starke Base??
Eine starke Säure wie Salzsäure HCl ionisiert auf folgende Weise:
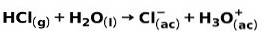
Eine starke Base wie Natriumhydroxid NaOH ionisiert auf folgende Weise:
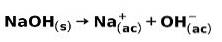
Beispiele für starke Säuren und ihre Formeln
| Starke Säuren | Formel |
|---|---|
| Salzsäure | HCl |
| Schwefelsäure | H.zweiSW4 |
| Salpetersäure | HNO3 |
| Bromwasserstoffsäure | HBr |
| Perchlorsäure | HClO4 |
| Chromsäure | H.zweiCrO4 |
| Tetrafluroborsäure | HBF4 |
Beispiele für starke Basen und ihre Formeln
| Starke Basis | Formel |
|---|---|
| Natriumhydroxid | NaOH |
| Lithiumhydroxid | LiOH |
| Kaliumhydroxid | KOH |
| Rubidiumhydroxid | RbOH |
| Cäsiumhydroxid | CsOH |
| Kalziumhydroxid | Ca (OH)zwei |
| Bariumhydroxid | Ba (OH)zwei |
| Strontiumhydroxid | Sr (OH)zwei |
| Aluminiumhydroxid | Al (OH)3 |
Vielleicht interessieren Sie sich für weitere Beispiele für Säuren und Basen.
Schwache Säuren und Basen
EIN Säure oder Base ist schwach, wenn sie in wässriger Lösung teilweise ionisiert wird, Das heißt, in der Lösung befinden sich Ionen und nichtionisierte Moleküle.
Wie ionisiert man eine Säure und eine schwache Base??
Eine schwache Säure wie Essigsäure CH3COOH wird auf folgende Weise ionisiert:
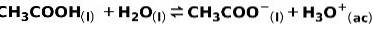
Das Gleichgewicht dieser Reaktion wird durch die beiden Pfeile in entgegengesetzte Richtungen ausgedrückt.
Wenn eine schwache Säure dissoziiert oder ionisiert, stellt sich ein Gleichgewicht zwischen den in der Lösung vorhandenen Spezies ein; Dies kann ausgedrückt werden durch a Ionisationskonstante sauer::
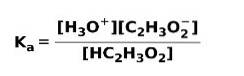
Die Ionisationskonstante ist nichts anderes als das Verhältnis zwischen der Multiplikation der Konzentration der Produkte und der Multiplikation der Konzentration der Reaktanten.
Eine schwache Base wie NH-Ammoniak3, ionisiert auf folgende Weise:
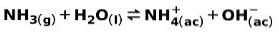
Wenn eine schwache Base dissoziiert oder ionisiert, stellt sich ein Gleichgewicht zwischen den in der Lösung vorhandenen Spezies ein; Dies kann ausgedrückt werden durch a Basenionisationskonstante::
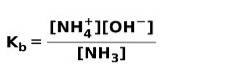
Vielleicht möchten Sie den Unterschied zwischen Säuren und Basen kennen.
Beispiele für schwache Säuren mit ihrer Formel und Säureionisationskonstante K.zu
| Schwache Säure | Formel | Ionisationskonstante |
|---|---|---|
| Ameisensäure | H.zweiCOzwei | 1,77 x 10-4 |
| Essigsäure | H.3CCOH | 1,75 x 10-5 |
| Blausäure | HOCN | 3,30 x 10-4 |
| Cyanwasserstoff | HCN | 6,20 x 10-10 |
| Hypochlorsäure | HOCl | 3,50 x 10-8 |
| Salpetersäure | HNOzwei | 4,00 x 10-4 |
| Milchsäure | HC3H.5ODER3 | 1,40 x 10-4 |
| Kohlensäure | H.zweiCO3 | 4,30 x 10-7 5,60 x 10-elf |
| Borsäure | H.3BO3 | 5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Beispiele für schwache Basen mit ihrer Formel und basischen Ionisationskonstante K.b
| Schwache Basis | Formel | Ionisationskonstante |
|---|---|---|
| Ammoniak | NH3 | 1,75 x 10-5 |
| Methylamin | CH3NHzwei | 4,38 x 10-4 |
| Ethylamin | C.zweiH.5NHzwei | 5,60 x 10-4 |
| Anilin | C.6H.5NHzwei | 3,80 x 10-10 |
| Pyridin | C.5H.5N. | 1,70 x 10-9 |
| Benzylamin | C.7H.9N. | 2,20 x 10-5 |
| Natriumbicarbonat | NaHCO | 2,00 x 10-4 |
Vielleicht möchten Sie mehr über die Eigenschaften von Säuren und Basen erfahren



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.