
Ideale Gasgesetzformel und -einheiten, Anwendungen, Beispiele
Das ideales Gasgesetz ist eine Zustandsgleichung, die eine Beziehung zwischen den Zustandsfunktionen beschreibt, die mit dem idealen Gas verbunden sind; wie Temperatur, Druck, Volumen und Anzahl der Mol. Dieses Gesetz ermöglicht es, reale Gassysteme zu untersuchen, indem sie mit ihren idealisierten Versionen verglichen werden..
Ein ideales Gas ist ein theoretisches Gas, das aus punktuellen oder kugelförmigen Partikeln besteht, die sich zufällig bewegen. mit großer kinetischer Energie, wobei die einzige Wechselwirkung zwischen ihnen vollständig elastische Stöße sind. Darüber hinaus entsprechen sie dem idealen Gasgesetz.

Bei Standarddruck und -temperatur (STP): 1 atm Druck und einer Temperatur von 0 ºC verhalten sich die meisten realen Gase qualitativ wie ideale Gase; solange ihre Dichte niedrig ist. Große intermolekulare oder interatomare Abstände (für Edelgase) erleichtern solche Annäherungen..
Unter STP-Bedingungen verhalten sich Sauerstoff, Stickstoff, Wasserstoff, Edelgase und einige Gase in zusammengesetzter Form wie Kohlendioxid wie ein ideales Gas..
Das ideale Gasmodell neigt dazu, bei niedrigen Temperaturen, hohen Drücken und hohen Teilchendichten zu versagen. wenn intermolekulare Wechselwirkungen sowie die Partikelgröße wichtig werden.
Das ideale Gasgesetz setzt sich aus drei Gasgesetzen zusammen: dem Gesetz von Boyle und Mariotte, dem Gesetz von Charles und Gay-Lussac und dem Gesetz von Avogadro..
Artikelverzeichnis
- 1 Formel und Einheiten
- 2 Was legt das ideale Gasgesetz fest??
- 3 Anwendungen
- 3.1 Berechnung der Dichte und Molmasse eines Gases
- 3.2 Berechnung des Volumens eines bei einer chemischen Reaktion entstehenden Gases
- 3.3 Berechnung der Partialdrücke der in einem Gemisch vorhandenen Gase
- 3.4 Volumen der in Wasser gesammelten Gase
- 4 Berechnungsbeispiele
- 4.1 Übung 1
- 4.2 Übung 2
- 4.3 Übung 3
- 4.4 Übung 4
- 5 Referenzen
Formel und Einheiten

Das Gasgesetz wird mathematisch mit der Formel ausgedrückt:
PV = nRT
Wobei P der von einem Gas ausgeübte Druck ist. Es wird normalerweise mit der Einheit der Atmosphäre (atm) ausgedrückt, obwohl es in anderen Einheiten ausgedrückt werden kann: mmHg, Pascal, Bar usw..
Das von einem Gas eingenommene Volumen V wird üblicherweise in Einheiten des Liters (L) ausgedrückt. Während n ist die Anzahl der Mol, R die universelle Gaskonstante und T die in Kelvin (K) ausgedrückte Temperatur..
Der am häufigsten verwendete Ausdruck in Gasen für R beträgt 0,08206 l atm K.-1Maulwurf-1. Obwohl die SI-Einheit für die Gaskonstante einen Wert von 8,3145 J mol hat-1K.-1. Beide sind gültig, solange auf die Einheiten der anderen Variablen (P, T und V) geachtet wird..
Das ideale Gasgesetz ist eine Kombination aus dem Gesetz von Boyle-Mariotte, dem Gesetz von Charles-Gay-Lussac und dem Gesetz von Avogadro.
Boyle-Mariotte-Gesetz
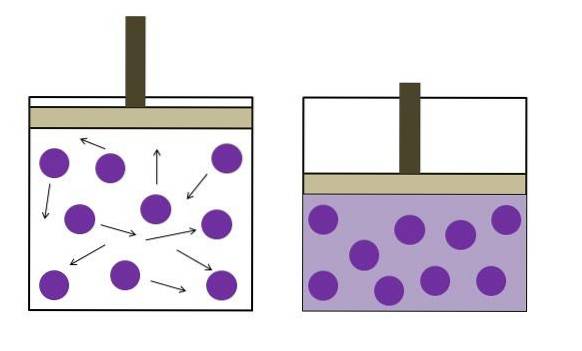
Es wurde unabhängig vom Physiker Robert Boyle (1662) und der Physikerin und Botanikerin Edme Mariotte (1676) formuliert. Das Gesetz lautet wie folgt: Bei konstanter Temperatur ist das Volumen einer festen Masse eines Gases umgekehrt proportional zu dem Druck, den es ausübt.
PV ∝ k
Mit einem Doppelpunkt:
P.1V.1 = P.zweiV.zwei
Charles-Gay-Lussac-Gesetz

Das Gesetz wurde 1803 von Gay-Lussac veröffentlicht, bezog sich jedoch auf das unveröffentlichte Werk von Jacques Charles (1787). Aus diesem Grund ist das Gesetz als Charles 'Gesetz bekannt..
Das Gesetz besagt, dass bei konstantem Druck eine direkte proportionale Beziehung zwischen dem von einem Gas eingenommenen Volumen und seiner Temperatur besteht.
V ∝ kzweiT.
Mit einem Doppelpunkt:
V.1/ T.1 = V.zwei/ T.zwei
V.1T.zwei = V.zweiT.1
Avogadros Gesetz
Das Gesetz wurde 1811 von Amadeo Avogadro verkündet und wies darauf hin, dass gleiche Volumina aller Gase bei gleichem Druck und gleicher Temperatur die gleiche Anzahl von Molekülen aufweisen.
V.1/ n1 = V.zwei/ nzwei
Was sagt das ideale Gasgesetz aus??
Das ideale Gasgesetz stellt eine Beziehung zwischen vier unabhängigen physikalischen Eigenschaften des Gases her: Druck, Volumen, Temperatur und Menge des Gases. Es reicht aus, den Wert von drei von ihnen zu kennen, um den Wert der verbleibenden zu erhalten.
Das Gesetz legt die Bedingungen fest, die angeben, wann sich ein Gas ideal verhält und wann es sich von diesem Verhalten entfernt.
Beispielsweise hat der sogenannte Kompressionsfaktor (PV / nRT) für ideale Gase den Wert 1. Eine Abweichung vom Wert 1 für den Kompressionsfaktor zeigt an, dass das Verhalten des Gases weit von dem eines idealen Gases entfernt ist.
Daher würde ein Fehler gemacht, wenn die ideale Gasgleichung auf ein Gas angewendet wird, das sich nicht gemäß dem Modell verhält.
Anwendungen
Berechnung der Dichte und Molmasse eines Gases
Die ideale Gasgesetzgleichung kann zur Berechnung der Dichte eines Gases und seiner Molmasse verwendet werden. Durch eine einfache Modifikation kann ein mathematischer Ausdruck gefunden werden, der die Dichte (d) eines Gases und seine Molmasse (M) in Beziehung setzt:
d = MP / RT
Und Clearing M:
M = dRT / P.
Berechnung des Volumens eines bei einer chemischen Reaktion entstehenden Gases
Die Stöchiometrie ist der Zweig der Chemie, der die Menge jedes der vorhandenen Reaktanten mit den Produkten in Beziehung setzt, die an einer chemischen Reaktion teilnehmen, im Allgemeinen ausgedrückt in Mol..
Die Verwendung der idealen Gasgleichung ermöglicht die Bestimmung des Volumens eines bei einer chemischen Reaktion erzeugten Gases; da die Anzahl der Mol aus der chemischen Reaktion erhalten werden kann. Dann kann das Volumen des Gases berechnet werden:
PV = nRT
V = nRT / P.
Durch Messen von V kann die Ausbeute oder der Fortschritt der Reaktion bestimmt werden. Wenn keine Gase mehr vorhanden sind, ist dies ein Hinweis darauf, dass die Reagenzien vollständig aufgebraucht sind.
Berechnung der Partialdrücke der in einem Gemisch vorhandenen Gase
Das ideale Gasgesetz kann zusammen mit dem Partialdruckgesetz von Dalton verwendet werden, um die Partialdrücke der verschiedenen in einem Gasgemisch vorhandenen Gase zu berechnen..
Die Beziehung gilt:
P = nRT / V.
Um den Druck jedes der in der Mischung vorhandenen Gase zu ermitteln.
Volumen der in Wasser gesammelten Gase
Es wird eine Reaktion durchgeführt, bei der ein Gas entsteht, das mittels einer Versuchsanordnung in Wasser gesammelt wird. Der Gesamtdruck des Gases plus der Wasserdampfdruck ist bekannt. Der Wert des letzteren kann in einer Tabelle erhalten werden und durch Subtraktion kann der Druck des Gases berechnet werden.
Aus der Stöchiometrie der chemischen Reaktion kann die Molzahl des Gases unter Anwendung der folgenden Beziehung erhalten werden:
V = nRT / P.
Das erzeugte Gasvolumen wird berechnet.
Berechnungsbeispiele
Übung 1
Ein Gas hat eine Dichte von 0,0847 g / l bei 17 ° C und einen Druck von 760 Torr. Was ist seine Molmasse? Was ist Gas??
Wir gehen von der Gleichung aus
M = dRT / P.
Wir rechnen zuerst die Temperatureinheiten in Kelvin um:
T = 17 ° C + 273,15 K = 290,15 K.
Und der Druck von 760 Torr entspricht dem von 1 atm. Jetzt müssen Sie nur noch die Werte ersetzen und lösen:
M = (0,0847 g / l) (0,08206 l atm K.-1Maulwurf-1) (290,15 K) / 1 atm
M = 2,016 g / mol
Diese Molmasse kann einer einzelnen Spezies entsprechen: dem zweiatomigen Wasserstoffmolekül H.zwei.
Übung 2
Eine Masse von 0,00553 g Quecksilber (Hg) in der Gasphase wird in einem Volumen von 520 l und einer Temperatur von 507 K gefunden. Berechnen Sie den von Hg ausgeübten Druck. Die Molmasse von Hg beträgt 200,59 g / mol.
Das Problem wird mit folgender Gleichung gelöst:
PV = nRT
Informationen über die Anzahl der Mol Hg erscheinen nicht; Sie können jedoch unter Verwendung ihrer Molmasse erhalten werden:
Molzahl Hg = (0,00553 g Hg) (1 Mol Hg / 200,59 g)
= 2.757 10-5 Maulwürfe
Jetzt müssen wir nur noch nach P auflösen und die Werte ersetzen:
P = nRT / V.
= (2.757 10-5 Mol) (8,20610-zwei L atm K.-1Maulwurf-1) (507 K) / 520 l
= 2,2 10-6 Geldautomat
Übung 3
Berechnen Sie den Druck der Salzsäure, die durch Umsetzung von 4,8 g Chlorgas (Clzwei) mit Wasserstoffgas (H.zwei), in einem Volumen von 5,25 l und bei einer Temperatur von 310 K. Die Molmasse von Clzwei beträgt 70,9 g / mol.
H.2 g) + Cl2 g) → 2 HCl(G)
Das Problem wird unter Verwendung der idealen Gasgleichung gelöst. Die Menge an HCl wird jedoch in Gramm und nicht in Mol ausgedrückt, so dass die richtige Umwandlung erfolgt.
Mol HCl = (4,8 g Clzwei) (1 Mol Clzwei/ 70,9 g Clzwei) (2 Mol HCl / 1 Mol Clzwei)
= 0,135 Mol HCl
Anwendung der idealen Gasgesetzgleichung:
PV = nRT
P = nRT / V.
= (0,135 Mol HCl) (0,08206 l atm K.-1Maulwurf-1) (310 K) / 5,25 l
= 0,65 atm
Übung 4
Eine 0,130 g Probe einer gasförmigen Verbindung nimmt ein Volumen von 140 ml bei einer Temperatur von 70 ° C und einem Druck von 720 Torr ein. Was ist seine Molmasse?
Um die ideale Gasgleichung anzuwenden, müssen zunächst einige Änderungen vorgenommen werden:
V = (140 ml) (1 l / 1000 ml)
= 0,14 l
Wenn wir das Volumen in Litern nehmen, müssen wir jetzt die Temperatur in Kelvin ausdrücken:
T = 70 ºC + 273,15 K = 243,15 K.
Und schließlich müssen wir den Druck in Atmosphäreneinheiten umrechnen:
P = (720 Torr) (1 atm / 760 Torr)
= 0,947 atm
Der erste Schritt zur Lösung des Problems besteht darin, die Molzahl der Verbindung zu erhalten. Hierfür wird die ideale Gasgleichung verwendet und wir lösen nach n::
PV = nRT
n = PV / RT
= (0,947 atm) (0,14 l) / (0,08206 l atm K.-1Maulwurf-1) (243,15 K)
= 0,067 Mol
Sie müssen nur die Molmasse berechnen, indem Sie die Gramm durch die erhaltenen Mol dividieren:
Molmasse = Gramm Verbindung / Molzahl.
= 0,130 g / 0,067 Mol
= 19,49 g / mol
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Ira N. Levine. (2014). Prinzipien der Physikochemie. Sechste Ausgabe. Mc Graw Hill.
- Glasstone. (1970). Abhandlung über physikalische Chemie. Zweite Ausgabe. Aguilar.
- C. K. Mathews, K. E. Van Holde und K. G. Ahern (2002). Biochemie. 3es war Auflage. Herausgeber Pearson Addison Wesley.
- Wikipedia. (2019). Ideales Gas. Wiederhergestellt von: en.wikipedia.org
- Redaktion. (2018). Boyle'sches Gesetz oder Boyle-Mariotte'sches Gesetz | Gesetze der Gase. Wiederhergestellt von: iquimicas.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.