
Sulfonsäurestruktur, Nomenklatur, Eigenschaften, Verwendungen

Es wird genannt Sulfonsäure jede Verbindung, die zu einer Familie organischer Säuren gehört, die eine oder mehrere -SO-Gruppen aufweisen3H. Bestimmte Autoren geben an, dass die Ausgangsverbindung H-S (= O) ist.zwei-OH oder H-SO3H, von etwas "Sulfonsäure" genannt, ist jedoch weder seine Existenz noch die seines Tautomers HO-S (= O) -OH, bekannt als "schweflige Säure" (H), nachgewiesen wordenzweiSW3), weder in Lösung noch im festen Zustand.
Letzteres ist darauf zurückzuführen, dass Schwefeldioxidgas (IV) (SOzwei) in wässriger Lösung in Bisulfitionen (HSO) umgewandelt3-) und Pyrosulfit (S.zweiODER5zwei-) und nicht H-S (= O)zwei-OH noch zu HO-S (= O) -OH, was bereits von vielen chemischen Forschern verifiziert wurde.
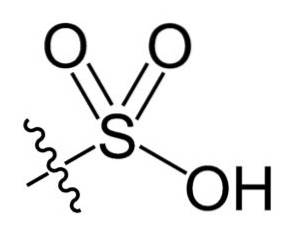
In der chemischen Formel R-SO3H von Sulfonsäuren kann die Gruppe R Kohlenwasserstoffgerüste wie Alkan, Alken, Alkin und / oder Aren darstellen. Diese können unter anderem sekundäre Funktionalitäten wie Ester-, Ether-, Keton-, Amino-, Amido-, Hydroxyl-, Carboxyl- und Phenolgruppen enthalten..
Sulfonsäuren sind starke Säuren, vergleichbar mit Schwefelsäure (H.zweiSW4). Der Rest seiner Eigenschaften hängt jedoch weitgehend von der Art der R-Gruppe ab..
Einige neigen dazu, bei hohen Temperaturen zu desulfonieren. Dies bedeutet den Verlust der -SO-Gruppe3H, insbesondere wenn R ein Aren ist, dh mit einem Benzolring.
Sulfonsäuren haben abhängig von ihrer chemischen Formel viele Verwendungszwecke. Sie werden unter anderem zur Herstellung von Farbstoffen, Tinten, Polymeren, Detergenzien, Tensiden und als Katalysatoren verwendet..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 4 Erhalten
- 4.1 Arylsulfonsäuren
- 4.2 Alkylsulfonsäuren
- 5 Verwendungen
- 5.1 Sulfonsäuren für Tenside und Waschmittel
- 5.2 Farbstoffe auf Sulfonsäurebasis
- 5.3 Amide auf Sulfonsäurebasis
- 5.4 Fluorierte und chlorfluorierte Sulfonsäuren
- 5.5 In biologischen Anwendungen
- 5.6 In der Ölindustrie
- 5.7 Bei der Formulierung von Schmiermitteln und Korrosionsschutzmitteln
- 6 Referenzen
Struktur
Sulfonsäuren haben folgende allgemeine Struktur:
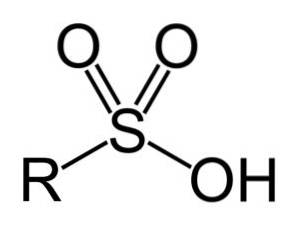
Nomenklatur
- Sulfonylgruppe: -SO3H.
- Alkyl- oder Arylsulfonsäure: R-SO3H.
Eigenschaften
Sie sind je nach Gruppe R fest oder flüssig. Gasförmige Sulfonsäuren sind nicht bekannt.
Ihre physikalischen und chemischen Eigenschaften hängen von der Art der R-Gruppe ab. Zum Vergleich werden einige physikalische Eigenschaften verschiedener Sulfonsäuren dargestellt. ist der Schmelzpunkt und z.B. ist der Siedepunkt bei einem Druck von 1 mm Hg:
- Methansulfonsäure: Smp. 20 ° C; z.B. 122 ºC
- Ethansulfonsäure: Smp. -17 ° C; z.B. 123 ºC
- Propansulfonsäure: Smp. -37 ° C; z.B. 159 ºC
- Butansulfonsäure: Smp. -15 ° C; z.B. 149 ºC
- Pentansulfonsäure: Smp. -16 ° C; z.B. 163 ºC
- Hexansulfonsäure: Smp. 16 ° C; z.B. 174 ºC
- Benzolsulfonsäure: Smp. 44 ° C; z.B. 172 ºC (bei 0,1 mm Hg)
- P-Toluolsulfonsäure: Smp. 106 ° C; z.B. 182 ºC (bei 0,1 mm Hg)
- 1-Naphthalinsulfonsäure: Smp. 78 ° C; z.B. Es zersetzt sich
- 2-Naphthalinsulfonsäure: Smp. 91 ° C; z.B. Es zersetzt sich
- Trifluormethansulfonsäure: Smp. keiner; z.B. 162 ºC (bei 760 mm Hg)
Die meisten sind in Wasser sehr gut löslich.
Sulfonsäuren sind noch saurer als Carbonsäuren. Sie haben einen ähnlichen Säuregehalt wie Schwefelsäure. In wässrigem Natriumhydroxid und wässrigem Bicarbonat lösen.
Sie neigen dazu, sich thermisch zu zersetzen und ihre Desulfonierung zu verursachen. Einige der Alkansulfonsäuren sind jedoch thermisch stabil. Insbesondere Triflinsäure oder Trifluormethansulfonsäure ist eine der stärksten und stabilsten Säuren.
Erhalten
Arylsulfonsäuren
Arylsulfonsäuren werden im Allgemeinen durch das Sulfonierungsverfahren erhalten, das aus der Zugabe eines Überschusses an rauchender Schwefelsäure (H) bestehtzweiSW4 + SW3) zu der organischen Verbindung, die wir sulfonieren wollen. Zum Beispiel im Fall von Benzol:
C.6H.6 + H.zweiSW4 <-> C.6H.5SW3H + H.zweiODER
ArH + H.zweiSW4 <-> ArSO3H + H.zweiODER
Die Sulfonierung ist eine reversible Reaktion, denn wenn wir Benzolsulfonsäure mit verdünnter Säure versetzen und Dampf über das Gemisch leiten, wird die SO-Eliminierungsreaktion erzeugt.3 und das Benzol wird durch Verflüchtigung mit Dampf destilliert, wodurch das Gleichgewicht in Richtung Desulfonierung verschoben wird.
Das Sulfonierungsmittel kann auch Chlorschwefelsäure, Sulfaminsäure oder Sulfitionen sein..
Alkylsulfonsäuren
Diese werden im Allgemeinen durch Sulfooxidation hergestellt, dh Behandlung von Alkylverbindungen mit Schwefeldioxid SOzwei und Sauerstoff O.zwei, oder direkt mit Schwefeltrioxid SO3.
RH + 2SOzwei + ODERzwei + H.zweiODER <--> R-SO3H + H.zweiSW4
Anwendungen
Sulfonsäuren für Tenside und Waschmittel
Alkylbenzolsulfonsäuren werden bei der Herstellung von Waschmitteln verwendet und sind eine der am weitesten verbreiteten Anwendungen.
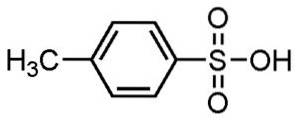
Wird für Pulver- und Flüssigwaschmittel, leichte oder schwere Reinigungsmittel, Handseifen und Shampoo verwendet.
Die aktiven Komponenten sind im Allgemeinen lineare Alkylbenzolsulfonate und sulfonierte Fettester..
Übliche Tenside sind Alpha-Olefinsulfonate, Sulfobetaine, Sulfosuccinate und Alkyldiphenyletherdisulfonate, die alle von Sulfonsäuren abgeleitet sind..
Diese Tenside finden Verwendung in Haushaltsreinigungsprodukten, Kosmetika, Emulsionspolymerisation und landwirtschaftlicher chemischer Herstellung..
Lignosulfonate sind sulfonierte Derivate von Lignin, einem Bestandteil von Holz, und werden als Dispergiermittel, Netzmittel, Bindemittel in Straßenbelägen, Betonzusatzmitteln und Zusatzstoffen in Tierfutter verwendet..
Ein Derivat von 2-Naphthalinsulfonsäure wird verwendet, um die Fließfähigkeit und Festigkeit von Zement zu erhöhen..
Farbstoffe auf Sulfonsäurebasis
Diese sind im Allgemeinen dadurch gekennzeichnet, dass sie Azogruppen enthalten (R-N = N-R).
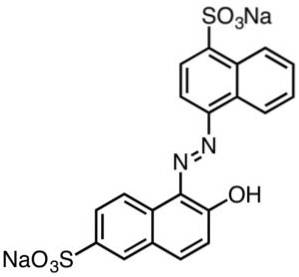
Von Sulfonsäuren abgeleitete Farbstoffe sind in der Papierindustrie nützlich, Tinten wie Tintenstrahldruck, Textilien wie Baumwolle und Wolle, Kosmetika, Seifen, Waschmittel, Lebensmittel und Leder..
Ein Derivat der 2-Naphthalinsulfonsäure wird auch als Bestandteil in Farbstoffen für Polyesterfasern und zum Ledergerben verwendet..
Amide auf Sulfonsäurebasis
Acrylamidosulfonsäuren zeichnen sich in dieser Anwendung aus, die in Polymeren, bei der galvanischen Abscheidung von Metallen, als Tenside und in transparenten Antibeschlagbeschichtungen eingesetzt werden..
Sie werden auch zur verbesserten Ölrückgewinnung, als Bodenfreisetzungsmittel, in hydraulischen Zementmischungen und als Beschleuniger zur Aushärtung von Aminoplastenharzen verwendet..
Einige Sulfonamide werden auch in Insektizidformeln verwendet.
Fluorierte und chlorfluorierte Sulfonsäuren
In dieser Gruppe ist Trifluormethansulfonsäure (CF.3SW3H), auch Triflsäure genannt. Diese Verbindung findet Anwendung in der organischen Synthese und Katalyse von Polymerisationsreaktionen.
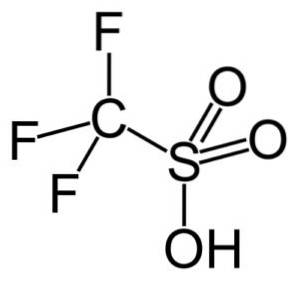
Beispielsweise wird es bei der Polymerisation von aromatischen Olefinen und bei der Herstellung hochverzweigter paraffinischer Kohlenwasserstoffe mit einer hohen Oktanzahl zur Verwendung als Kraftstoffadditive verwendet..
Eine weitere Anwendung liegt in der Synthese leitfähiger Polymere durch Dotierung von Polyacetylen, wobei beispielsweise Halbleitertypen hergestellt werden p.
Pentafluorethansulfonsäure (CF.3CF.zweiSW3H), bekannt als Pentaphilsäure, wird als organischer Katalysator verwendet.
Triflinsäure wird mit Antimonpentafluorid (SbF) umgesetzt5) Erzeugung der sogenannten "magischen Säure", eines Supersäurekatalysators, der zur Alkylierung und Polymerisation dient.
Nafion-H ist ein Ionenaustauscherharz einer perfluorierten polymeren Sulfonsäure. Es hat die Eigenschaft, gegenüber starken Säuren, starken Basen und Reduktions- oder Oxidationsmitteln inert zu sein..
In biologischen Anwendungen
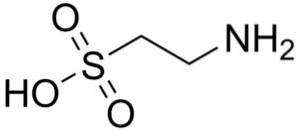
Eine der wenigen in der Natur vorkommenden Sulfonsäuren ist 2-Aminoethansulfonsäure, besser bekannt als Taurin, eine essentielle Aminosäure, insbesondere für Katzen.
Synthetisches und natürliches Taurin werden als Nahrungsergänzungsmittel in Tiernahrung und Pharmazeutika verwendet..
Taurocholsäure ist Bestandteil der Galle und an der Verdauung von Fetten beteiligt. 8-Anilino-1-naphthalinsulfonsäure, eine synthetische Verbindung, wird zur Untersuchung von Proteinen verwendet.
Copolymere von Harnstoff und Biphenyldisulfonsäure wurden als Inhibitoren des Herpes-simplex-Virus verwendet.
Einige Derivate von Sulfonsäuren, wie sulfoniertes Polystyrol und einige Azoverbindungen, haben inhibitorische Eigenschaften des humanen Immundefizienzvirus oder HIV gezeigt, ohne übermäßig toxisch gegen Wirtszellen zu sein.
In der Ölindustrie
Bestimmte Gemische von Erdölderivaten, die eine vielfältige Kombination von Aromaten, Paraffinen und mehrkernigen Aromaten enthalten, können sulfoniert und dann ordnungsgemäß neutralisiert werden, wodurch sogenannte Erdölsulfonate entstehen..
Diese Erdölsulfonate haben die Eigenschaft, die Oberflächenspannung von Erdöl in Wasser zu senken. Darüber hinaus ist die Herstellung sehr kostengünstig.
Aus diesem Grund werden Erdölsulfonate in vorhandene Ölquellen injiziert, um die Rückgewinnung von Rohöl zu unterstützen, das zwischen Gesteinen unter der Oberfläche eingeschlossen ist.
Bei der Formulierung von Schmiermitteln und Korrosionsschutzmitteln
Magnesiumsulfonate werden häufig in Schmiermittelformulierungen als Waschmittel-Dispergiermittel-Additive und zur Verhinderung von Verschleiß verwendet..
Bariumsulfonate werden in Wälzlagern verwendet, die in Hochgeschwindigkeitsanwendungen verwendet werden. Natrium- und Calciumsulfonate finden Anwendung in Getriebeschmiermitteln und -fetten, um die Eigenschaften des extremen Drucks zu verbessern.
Magnesiumsalze von Sulfonsäuren eignen sich auch für Korrosionsschutzanwendungen wie Beschichtungen, Fette und Harze..
Verweise
- Falk, Michael und Giguere, Paul A. (1958). Über die Natur der schwefligen Säure. Canadian Journal of Chemistry, Vol. 36, 1958. Von nrcresearchpress.com wiederhergestellt
- Betts, R.H. und Voss, R.H. (1970). Die Kinetik des Sauerstoffaustauschs zwischen dem Sulfition und Wasser. Canadian Journal of Chemistry, Vol. 48, 1970. Von nrcresearchpress.com wiederhergestellt
- Cotton, F.A. und Wilkinson, G. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. Kapitel 16. John Wiley & Sons.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 23. Vierte Ausgabe. John Wiley & Sons.
- Kosswig, Kurt. (2012). Tenside. Ullmanns Encyclopedia of Industrial Chemistry Vol. 35. Wiley-VCH Verlag GmbH & Co..



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.