
Schwefelwasserstoff (H2S) -Struktur, Eigenschaften, Verwendungen, Bedeutung

Das Schwefelwasserstoff oder Schwefelwasserstoff ist ein Gas, das durch die Vereinigung eines Schwefelatoms (S) und zweier Wasserstoffatome (H) gebildet wird. Seine chemische Formel lautet H.zweiS. Auch als Schwefelwasserstoffgas bekannt. Es ist ein farbloses Gas, dessen Geruch in faulen Eiern erkennbar ist.
Es kommt in Vulkanen und schwefelhaltigen heißen Quellen, in Erdgas und in Rohöl vor. Es entsteht auch bei der anaeroben Zersetzung (ohne Sauerstoff) von pflanzlichen und tierischen organischen Stoffen. Es kommt auf natürliche Weise im Säugetierkörper durch die Wirkung bestimmter Enzyme auf Cystein, eine nicht essentielle Aminosäure, vor.
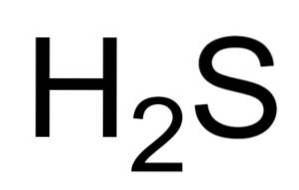
Wässrige Lösungen von H.zweiS sind korrosiv gegenüber Metallen wie Stahl. Die H.zweiS ist eine reduzierende Verbindung, die bei Reaktion mit SOzwei , oxidiert zu elementarem Schwefel und reduziert sich zu SOzwei auch Schwefel.
Obwohl es sich um eine hochgiftige und tödliche Verbindung für Mensch und Tier handelt, wird ihre Bedeutung für eine Reihe wichtiger Prozesse im Körper seit einigen Jahren untersucht..
Reguliert eine Reihe von Mechanismen, die mit der Erzeugung neuer Blutgefäße und der Funktion des Herzens zusammenhängen.
Schützt Neuronen und wirkt vermutlich gegen Krankheiten wie Parkinson und Alzheimer.
Aufgrund seiner chemischen Reduktionskapazität kann es oxidative Spezies bekämpfen und so der Zellalterung entgegenwirken. Aus diesen Gründen wird die Möglichkeit untersucht, Medikamente herzustellen, die bei Verabreichung an Patienten langsam in den Körper freigesetzt werden können..
Dies würde dazu dienen, Pathologien wie Ischämie, Diabetes und neurodegenerative Erkrankungen zu behandeln. Der Wirkungsmechanismus und die Sicherheit müssen jedoch noch eingehend untersucht werden..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Physikalische Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Dichte
- 3.6 Löslichkeit
- 4 Chemische Eigenschaften
- 4.1 In wässriger Lösung
- 4.2 Reaktion mit Sauerstoff
- 4.3 Reaktion mit Metallen
- 4.4 Reaktion mit Schwefeldioxid
- 4.5 Zersetzung mit der Temperatur
- 5 Lage in der Natur
- 6 Synthese im Säugetierorganismus
- 7 Im Labor oder industriell erhalten
- 8 Industrielle Verwendung von H2S zur Erzeugung von Schwefel
- 9 Nützlichkeit oder Bedeutung von endogenem H2S im Körper
- 9.1 Herz-Kreislauf-System
- 9.2 Magen-Darm-System
- 9.3 Zentralnervensystem
- 9.4 Sehorgan
- 9.5 Gegen Alterung
- 9.6 Heilungspotential von exogen zugeführtem H2S
- 10 Risiken
- 11 Referenzen
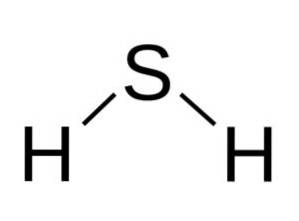
Struktur
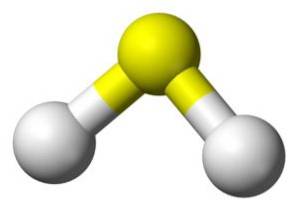
Das H-MolekülzweiS ist analog zu Wasser, dh sie haben eine ähnliche Form, da sich die Wasserstoffatome in einem Winkel zum Schwefel befinden.
Schwefel in H.zweiS hat die folgende elektronische Konfiguration:
1szwei, 2szwei 2 P.6, 3szwei 3p6,
Nun, es leiht sich von jedem Wasserstoff ein Elektron aus, um seine Valenzschale zu vervollständigen..
Nomenklatur
- Schwefelwasserstoff
- Schwefelwasserstoff
- Schwefelhydrid.
Physikalische Eigenschaften
Körperlicher Status
Farbloses Gas mit sehr unangenehmem Geruch.
Molekulargewicht
34,08 g / mol.
Schmelzpunkt
-85,60 ºC.
Siedepunkt
-60,75 ºC.
Dichte
1,1906 g / l.
Löslichkeit
In Wasser mäßig löslich: 2,77 Volumina in 1 Wasser bei 20 ° C. Kann durch Kochen vollständig aus der wässrigen Lösung entfernt werden.
Chemische Eigenschaften
In wässriger Lösung
Wenn sich Schwefelwasserstoff in wässriger Lösung befindet, spricht man von Schwefelwasserstoff. Es ist eine schwache Säure. Es hat zwei ionisierbare Protonen:
H.zweiS + H.zweiO ⇔ H.3ODER+ + HS-, K.a1 = 8,9 x 10-8
HS- + H.zweiO ⇔ H.3ODER+ + S.zwei-, K.a2 ∼ 10-14
Das erste Proton ionisiert leicht, wie aus seiner ersten Ionisationskonstante abgeleitet werden kann. Das zweite Proton ionisiert sehr wenig, aber Lösungen von H.zweiS enthält einen Teil des Sulfidanions S.zwei-.
Wenn die Lösung von H.zweiS ist Luft ausgesetzt, O.zwei oxidiert zum Sulfidanion und fällt Schwefel aus:
2 S.zwei- + 4 h+ + ODERzwei → 2 H.zweiO + 2 S.0↓ (1)
In Gegenwart von Chlor Clzwei, Brom Brzwei und Jod ichzwei der entsprechende Halogenwasserstoff und Schwefel werden gebildet:
H.zweiS + Brzwei → 2 HBr + S.0↓ (2)
Wässrige Lösungen von H.zweiS sind ätzend, erzeugen Sulfidspannungsrisse in Stählen mit hoher Härte. Korrosionsprodukte sind Eisensulfid und Wasserstoff.
Reaktion mit Sauerstoff
Die H.zweiS reagiert mit Luftsauerstoff und es können folgende Reaktionen auftreten:
2 hzweiS + 3 O.zwei → 2 H.zweiO + 2 SOzwei (3)
2 hzweiS + O.zwei → 2 H.zweiO + 2 S.0↓ (4)
Reaktion mit Metallen
Es reagiert mit verschiedenen Metallen, die Wasserstoff verdrängen und das Metallsulfid bilden:
H.zweiS + Pb → PbS + H.zwei↑ (5)
Reaktion mit Schwefeldioxid
In vulkanischen Gasen ist H.zweiS und SOzwei, die miteinander reagieren und festen Schwefel bilden:
H.zweiS + SOzwei → 2 H.zweiO + 3 S.0↓ (6)
Zersetzung mit der Temperatur
Schwefelwasserstoff ist nicht sehr stabil, er zersetzt sich beim Erhitzen leicht:
H.zweiS → H.zwei↑ + S.0↓ (7)
Lage in der Natur
Dieses Gas kommt natürlich in schwefelhaltigen oder schwefelhaltigen heißen Quellen, in vulkanischen Gasen, in Rohöl und in Erdgas vor..

Wenn Öl (oder Gas) signifikante Spuren von H enthältzweiS soll "sauer" sein, im Gegensatz zu "süß", wenn es es nicht enthält.
Kleine Mengen von H.zweiS in Öl oder Gas sind wirtschaftlich schädlich, da eine Waschanlage installiert werden muss, um es zu entfernen, sowohl um Korrosion zu verhindern als auch um das Abgas für den Hausgebrauch als Brennstoff sicher zu machen.
Es entsteht immer dann, wenn sich schwefelhaltige organische Stoffe unter anaeroben Bedingungen (Abwesenheit von Luft) zersetzen, z. B. menschliche, tierische und pflanzliche Abfälle.

Bakterien, die im Mund und im Magen-Darm-Trakt vorhanden sind, produzieren es aus den abbaubaren Materialien, die in pflanzlichen oder tierischen Proteinen enthalten sind..
Sein charakteristischer Geruch macht es in faulen Eiern spürbar.
Die H.zweiS wird auch in bestimmten industriellen Aktivitäten wie Ölraffinerien, Koksöfen, Papierfabriken, Gerbereien und in der Lebensmittelverarbeitung hergestellt.
Synthese im Säugetierorganismus
Die H.zweiEndogenes S kann in Säugetiergeweben, einschließlich Menschen, auf zwei Wegen hergestellt werden, einem enzymatischen und einem nichtenzymatischen.
Der nichtenzymatische Weg besteht in der Reduktion von elementarem Schwefel S.0 zu H.zweiS durch Oxidation von Glucose:
2 C.6H.12ODER6 (Glucose) + 6 S.0 (Schwefel) + 3 H.zweiO → 3 C.3H.6ODER3 + 6 hzweiS + 3 COzwei (8)
Der enzymatische Weg besteht aus der Produktion von H.zweiS aus L-Cystein, einer vom Körper synthetisierten Aminosäure. Der Prozess wird durch mehrere Enzyme sichergestellt, wie z. B. Cystathionin-β-Synthase und Cystathionin-γ-Lyase..

Beschaffung im Labor oder industriell
Wasserstoffgas (H.zwei) und das Element Schwefel (S) reagieren bei normalen Umgebungstemperaturen nicht, aber oberhalb dieser beginnen sie sich zu verbinden, wobei 310 ºC die optimale Temperatur ist.
Der Prozess ist jedoch zu langsam, so dass andere Methoden verwendet werden, um ihn zu erhalten, einschließlich der folgenden.
Metallsulfide (wie Eisensulfid) werden mit Säuren (wie Salzsäure) in verdünnter Lösung umgesetzt.
FeS + 2 HCl → FeClzwei + H.zweiS ↑ (9)
Auf diese Weise wird das Gas H.zweiS, das aufgrund seiner Toxizität sicher gesammelt werden muss.
Industrielle Nutzung von H.zweiS, um Schwefel zu erzeugen
Lagerung und Transport in großen Mengen von H.zweiDie Trennung von Erdgas durch Aminwäsche ist schwierig, daher wird es nach dem Claus-Verfahren in Schwefel umgewandelt.

Dabei treten zwei Reaktionen auf. Im ersten der H.zweiS reagiert mit Sauerstoff zu SOzwei, wie oben erwähnt (siehe Reaktion 3).
Die zweite ist eine Eisenoxid-katalysierte Reaktion, bei der SOzwei wird reduziert und die H.zweiS oxidiert und beide produzieren Schwefel S (siehe Reaktion 6).
Auf diese Weise wird Schwefel erhalten, der leicht gelagert und transportiert werden kann und für mehrere Zwecke bestimmt ist..
Nützlichkeit oder Wichtigkeit von H.zweiS endogen im Körper
Die H.zweiEndogenes S ist dasjenige, das auf natürliche Weise im Körper als Teil des normalen Stoffwechsels bei Menschen, Säugetieren und anderen Lebewesen vorkommt.
Trotz seines langjährigen Rufs als giftiges und giftiges Gas, das mit der Zersetzung organischer Stoffe verbunden ist, haben mehrere neuere Studien von den 2000er Jahren bis heute festgestellt, dass H.zweiEndogenes S ist ein wichtiger Regulator bestimmter Mechanismen und Prozesse im Lebewesen.
Die H.zweiS hat eine hohe Lipophilie oder Affinität zu Fetten, so dass es Zellmembranen leicht durchquert und alle Zelltypen durchdringt.
Herz-Kreislauf-System
Bei Säugetieren fördert oder reguliert Schwefelwasserstoff eine Reihe von Signalen, die den Stoffwechsel, die Herzfunktion und das Überleben der Zellen regulieren..
Es hat eine starke Wirkung auf das Herz, die Blutgefäße und die zirkulierenden Elemente des Blutes. Moduliert den Zellstoffwechsel und die Mitochondrienfunktion.
Schützt die Nieren vor Schäden durch Ischämie.
Magen-Darm-System
Es spielt eine wichtige Rolle als Schutzfaktor gegen Schädigungen der Magenschleimhaut. Es wird geschätzt, dass es ein wichtiger Mediator der gastrointestinalen Motilität sein kann.
Es ist wahrscheinlich an der Kontrolle der Insulinsekretion beteiligt.
Zentrales Nervensystem
Es wirkt auch in wichtigen Funktionen des Zentralnervensystems und schützt Neuronen vor oxidativem Stress.
Es wird geschätzt, dass es vor neurodegenerativen Erkrankungen wie Parkinson, Alzheimer und Hungtinton schützen kann.
Organ der Vision
Schützt retinale Photorezeptorzellen vor lichtinduzierter Degeneration.
Gegen das Altern
Die H.zweiDa es sich um eine reduzierende Spezies handelt, kann es von einer Vielzahl von Oxidationsmitteln konsumiert werden, die im Körper zirkulieren. Bekämpft oxidierende Spezies wie reaktive Sauerstoffspezies und reaktive Stickstoffspezies im Körper.
Begrenzt Reaktionen durch freie Radikale durch die Aktivierung von antioxidativen Enzymen, die vor den Auswirkungen des Alterns schützen.
Heilungspotential von H.zweiS exogen geliefert
Die Bioverfügbarkeit von H.zweiEndogenes S hängt von bestimmten Enzymen ab, die an der Cysteinbiosynthese bei Säugetieren beteiligt sind.
Einige Studien legen nahe, dass H-Spender medikamentöse TherapiezweiS könnte für bestimmte Pathologien von Vorteil sein.
Zum Beispiel könnte es bei Diabetikern nützlich sein, da beobachtet wurde, dass sich die Blutgefäße von Diabetikern mit Arzneimitteln verbessern, die H liefernzweiS exogen.
Die H.zweiExogen verabreichtes S erhöht die Angiogenese oder die Bildung von Blutgefäßen, so dass es zur Behandlung chronischer ischämischer Erkrankungen verwendet werden kann.
Es werden Medikamente entwickelt, die H freisetzen könnenzweiS langsam in der Lage zu sein, bei verschiedenen Krankheiten vorteilhaft zu wirken. Die Wirksamkeit, Sicherheit und Wirkmechanismen müssen jedoch noch untersucht werden..
Risiken
Die H.zweiS ist ein tödliches Gift, wenn es sauber eingeatmet oder sogar 1 Teil Gas in 200 Teilen Luft verdünnt wird. Vögel reagieren sehr empfindlich auf H.zweiS und sterben auch bei Verdünnung von 1 in 1500 Teilen Luft.

Die H.zweiS ist ein starker Inhibitor bestimmter Enzyme und oxidativer Phosphorylierungsprozesse, die zum Ersticken der Zellen führen. Die meisten Menschen riechen es in Konzentrationen von mehr als 5 ppb (Teile pro Milliarde). Konzentrationen von 20-50 ppm (parts per million) reizen die Augen und die Atemwege.
Eine Inhalation von 100-250 ppm für einige Minuten kann zu Koordinationsstörungen, Gedächtnisstörungen und motorischen Störungen führen. Wenn die Konzentration bei etwa 150-200 ppm liegt, tritt olfaktorische Ermüdung oder Anosmie auf, was bedeutet, dass der charakteristische Geruch von H danach nicht mehr erkannt werden kann.zweiS. Wenn eine Konzentration von 500 ppm 30 Minuten lang inhaliert wird, können Lungenödeme und Lungenentzündung auftreten..
Konzentrationen von mehr als 600 ppm können innerhalb der ersten 30 Minuten tödlich sein, da die Atemwege gelähmt sind. Und 800 ppm ist die Konzentration, die für den Menschen sofort tödlich ist..
Es sollte daher vermieden werden, dass es zu Undichtigkeiten von H kommtzweiS in Labors, Räumlichkeiten oder an jedem Ort oder in jeder Situation.
Es ist wichtig zu beachten, dass viele Todesfälle auftreten, weil Menschen enge Räume betreten, um Mitarbeiter oder Familienmitglieder zu retten, die aufgrund einer H-Vergiftung zusammengebrochen sind.zweiJa, sie auch passieren.
Es ist ein brennbares Gas.
Verweise
- Panthi, S. et al. (2016). Physiologische Bedeutung von Schwefelwasserstoff: Aufkommender potenter Neuroprotektor und Neuromodulator. Oxidative Medizin und zelluläre Langlebigkeit. Band 2016. Artikel-ID 9049782. Von hindawi.com wiederhergestellt.
- Shefa, U. et al. (2018). Antioxidations- und Zellsignalfunktionen von Schwefelwasserstoff im Zentralnervensystem. Oxidative Medizin und zelluläre Langlebigkeit. Band 2018. Artikel-ID 1873962. Von hindawi.com wiederhergestellt.
- Tabassum, R. et al. (2020). Therapeutische Bedeutung von Schwefelwasserstoff bei altersbedingten neurodegenerativen Erkrankungen. Neural Regen Res 2020; 15: 653 & ndash; 662. Von nrronline.org wiederhergestellt.
- Martelli, A. et al. (2010). Schwefelwasserstoff: Neue Möglichkeit zur Wirkstoffentdeckung. Medizinische Forschungsberichte. Band 32, Ausgabe 6. Von onlinelibrary.wiley.com wiederhergestellt.
- Wang, M.-J. et al. (2010). Mechanismen der Angiogenese: Rolle von Schwefelwasserstoff. Clinical and Experimental Pharmacology and Physiology (2010) 37, 764 & ndash; 771. Von onlinelibrary.wiley.com wiederhergestellt.
- Dalefield, R. (2017). Rauch und andere inhalative Giftstoffe. Schwefelwasserstoff. In Veterinary Toxicology für Australien und Neuseeland. Von sciencedirect.com wiederhergestellt.
- Selley, R.C. und Sonnenberg, S.A. (2015). Die physikalischen und chemischen Eigenschaften von Erdöl. Schwefelwasserstoff. In Elementen der Erdölgeologie (dritte Ausgabe). Von sciencedirect.com wiederhergestellt.
- Hocking, M.B. (2005). Schwefel und Schwefelsäure. Claus-Prozessumwandlung von Schwefelwasserstoff zu Schwefel. Im Handbuch für chemische Technologie und Verschmutzungsbekämpfung (dritte Ausgabe). Von sciencedirect.com wiederhergestellt.
- Lefer, D.J. (2008). Mögliche Bedeutung von Veränderungen in Schwefelwasserstoff (H.zweiS) Bioverfügbarkeit bei Diabetes. British Journal of Pharmacology (2008) 155, 617-619. Von bpspubs.onlinelibrary.wiley.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Schwefelwasserstoff. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Babor, J.A. und Ibarz, J. (1965). Moderne Allgemeine Chemie. 7. Auflage. Editorial Marín, S.A..


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.