
Struktur, Eigenschaften, Verwendungen, Risiken von Natriumoxalat (Na2C2O4)
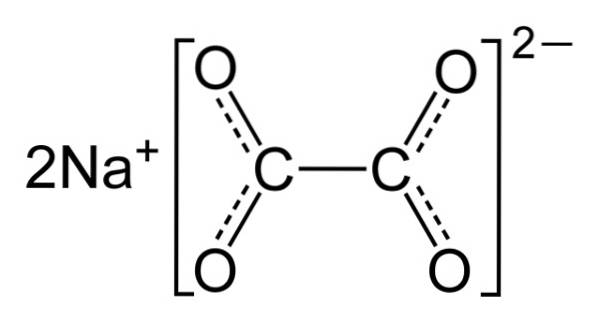
Das Natriumoxalat Es ist eine organische Verbindung, die aus zwei Natriumionen und einem Oxalation besteht. Seine chemische Formel lautet NazweiC.zweiODER4 oder auch Nazwei(GURREN)zwei. Es ist das Natriumsalz von Oxalsäure oder Ethandisäure. Dann einzweiC.zweiODER4 ist ein weißer kristalliner Feststoff und seine wässrigen Lösungen sind basisch (alkalisch).
Natriumoxalat ist in Pflanzen und Gemüse enthalten. Beim Menschen wird Oxalsäure auf natürliche Weise aus seiner konjugierten Säure erzeugt, die wiederum durch bestimmte Stoffwechselprozesse erzeugt wird.

Dann einzweiC.zweiODER4 Es wird in Laboratorien für chemische Analysen als Reduktionsmittel (das Gegenteil von Oxidationsmittel) verwendet. Auch zum Testen bestimmter organischer Verbindungen während der Abwasserbehandlung.
Es wurde zur Entsorgung von Abfällen aus Fluorchlorkohlenwasserstoffen (CGC) verwendet, die die Ozonschicht schädigen. Es ist auch ein Rohstoff, um Oxalsäure wirtschaftlich zu erhalten.
Aufgrund des hohen Natriumoxalatgehalts einiger essbarer Gemüsesorten sollten Personen, die zur Bildung von Steinen oder Nierensteinen neigen, den Verzehr solcher Lebensmittel vermeiden. Dies liegt daran, dass die Steine normalerweise mit Oxalaten gebildet werden..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Dichte
- 3.4 Löslichkeit
- 3,5 pH
- 3.6 Chemische Eigenschaften
- 4 Erhalten
- 4.1 Präsenz in der Natur
- 5 Verwendungen
- 5.1 In Laboratorien für chemische Analysen
- 5.2 Bei der Zerstörung von Fluorchlorkohlenwasserstoffen
- 5.3 Bei der Bestimmung wichtiger Parameter in der Abwasserbehandlung
- 5.4 Um Oxalsäure zu erhalten
- 5.5 Um unerwünschte Verbindungen zu entfernen
- 6 Risiken
- 7 Referenzen
Struktur
Natriumoxalat besteht aus zwei Natriumkationen Na+ und ein Oxalatanion (COO)zweizwei-. Das Oxalatanion besteht wiederum aus zwei COO-Einheiten- gebunden durch die zwei Kohlenstoffatome: -OOC-COO-.
In festem Natriumoxalat hat das Oxalatanion eine flache Form. Dies bedeutet, dass sich sowohl Kohlenstoffe als auch Sauerstoff in derselben Ebene befinden..
Nomenklatur
- Natriumoxalat
- Dinatriumoxalat
- Ethandisäure-Natriumsalz
Eigenschaften
Körperlicher Status
Festes weißes kristallines.
Molekulargewicht
134,0 g / mol
Dichte
2,27 g / cm3 bei 20 ° C..
Löslichkeit
In Wasser löslich: 3,7 g / 100 ml bei 20 ° C..
pH
Seine wässrigen Lösungen sind basisch (alkalisch), da das Oxalatanion dazu neigt, Protonen aus dem Wasser zu entnehmen, wodurch die OH-Ionen frei bleiben.-.
Chemische Eigenschaften
Es kann Säuren neutralisieren und die Reaktionen sind exotherm, das heißt, sie geben Wärme ab.
Es dient als Reduktionsmittel und erzeugt bei diesen Reaktionen Kohlendioxid-COzwei.
Es hat die Eigenschaft, stark an verschiedene Metallionen wie Eisenionen Fe zu bindenzwei+ und Eisen (III) Fe3+.
Erhalten
Laut einer konsultierten Quelle kann Natriumoxalat durch Oxidation von Kohlenstoff mit Sauerstoff O erhalten werdenzwei bei einer Temperatur von ca. 250 ° C in einer konzentrierten Lösung von Natriumhydroxid NaOH.
Präsenz in der Natur
Natriumoxalat ist in vielen Pflanzen und Gemüsen wie Mangold, Spinat und Rhabarber sowie in Getreide wie Sojabohnen und vielen anderen pflanzlichen Produkten enthalten..

Seine konjugierte Säure, Oxalsäure, wird im menschlichen Körper durch den Metabolismus von Glykolsäure oder Ascorbinsäure hergestellt. Einmal produziert, wird es nicht metabolisiert, sondern in Form von Oxalat im Urin ausgeschieden..

Anwendungen
In chemischen Analyselabors
Es wird als chemisches Reagenz verwendet, im Allgemeinen als Reduktionsmittel, beispielsweise zur Standardisierung von Kaliumpermanganatlösungen, dh um genau zu bestimmen, wie viel Natriumpermanganat sie enthalten.
Bei der Zerstörung von Fluorchlorkohlenwasserstoffen
Natriumoxalat wurde zur Zerstörung von Fluorchlorkohlenwasserstoffen (FCKW) verwendet. Diese FCKW-Verbindungen waren eine der Ursachen für die Zerstörung der Ozonschicht des Planeten (die uns vor ultravioletter Strahlung schützt)..
1996 schlugen einige Forscher die Verwendung von Natriumoxalat vor, um sie zu eliminieren, da es bei Temperaturen von 270 bis 290 ° C leicht mit FCKW reagiert und sie für die Ozonschicht unschädlich macht..
Die Reaktion von Natriumoxalat mit FCKW kann gesteuert werden, um halogenierte aromatische Kohlenwasserstoffe zu erhalten, die für die Ozonschicht nicht schädlich sind, aber nützliche Verbindungen in der chemischen Industrie sind..
Diese Reaktion kann auch maximiert werden und alle FCKW in Natriumfluorid NaF, Natriumchlorid NaCl, elementaren Kohlenstoff und Kohlendioxid CO umwandeln.zwei.

Bei der Bestimmung wichtiger Parameter in der Abwasserbehandlung
Natriumoxalat hat sich als nützlich erwiesen, um die Menge und Art der organischen Verbindungen zu messen, die von Mikroorganismen aus Schlamm abgesondert werden, der zur Abwasserbehandlung verwendet wird..
Die Messung solcher Verbindungen ist wichtig, um ihre Funktion während der Abwasserbehandlung zu bestimmen, da die Leichtigkeit der Trennung des Schlamms vom Wasser von ihnen abhängt..
Die Verwendung von Natriumoxalat vermeidet die Nachteile anderer Methoden.
Oxalsäure erhalten
Rohes Natriumoxalat aus bestimmten Prozessabfällen wurde zur Herstellung von Oxalsäure H verwendetzweiC.zweiODER4 in großen Mengen.
Das Verfahren verwendet Schlamm aus dem Bayer-Verfahren zur Behandlung von Bauxit (einem Aluminiumerz). Beim Bayer-Verfahren wird Bauxit mit Natriumhydroxid NaOH behandelt, um das Aluminiumoxid dieses Minerals aufzulösen.
Beim Auflösen von Aluminiumoxid werden bestimmte im Mineral vorhandene organische Verbindungen wie Huminsäuren von NaOH angegriffen, wodurch eine große Menge Natriumoxalat Na entstehtzweiC.zweiODER4.
Dieses Natriumoxalat wird mit Aluminiumverbindungen in einen Schlamm eingearbeitet. Zur Reinigung wird das Ganze gelöst, filtriert und durch eine Ionenaustauschersäule vom Säuretyp geleitet..
In der Säule befindet sich ein Sulfonsäureharz RSO3H wo Metallionen Na ausgetauscht werden+ durch Wasserstoffionen H.+, so erhält man Oxalsäure H.zweiC.zweiODER4.
RSO3H + NazweiC.zweiODER4 ⇔ RSO3Na + NaHCzweiODER4
RSO3H + NaHCzweiODER4 ⇔ RSO3Na + H.zweiC.zweiODER4
Dies ist ein kostengünstiges Verfahren und die erhaltene Oxalsäure ist von akzeptabler Reinheit..
Um unerwünschte Verbindungen zu entfernen
Konjugierte Säure von Natriumoxalat, Oxalsäure H.zweiC.zweiODER4, wird verwendet, um bestimmte Arten von Schmutz und Ablagerungen aufzulösen.
Es nutzt die Eigenschaft von Oxalsäure, sich in Oxalat umzuwandeln, das als Komplexbildner oder Fällungsmittel wirkt, beispielsweise bei der Verarbeitung von Abfällen aus verschiedenen Kernbrennstoffen.
Oxalsäure wird auch verwendet, um Mineralablagerungen und Eisenoxide in Rohren und anderen Geräten zu entfernen. Dies liegt an seiner Fähigkeit, beide Eisenionen Fe stark zu bindenzwei+ bezüglich des Eisen (III) -Ions Fe3+ Oxalate bilden.
Risiken
Wenn Natriumoxalat direkt eingeatmet oder eingenommen wird, verursacht es Schmerzen im Hals, in der Speiseröhre und im Magen. Erzeugt Erbrechen, starke Spülung, schwachen Puls, kardiovaskulären Kollaps, neuromuskuläre Symptome und Nierenschäden.
Personen, die aufgrund der Anreicherung von Oxalat im Urin zur Bildung von Nierensteinen neigen, sollten den Verzehr von Gemüse mit einem hohen Gehalt an löslichen Oxalaten wie Natrium vermeiden.
Natriumoxalat in großen Mengen in Lebensmitteln, wenn es den Urin erreicht, bindet an das darin enthaltene Kalzium und kann bei Menschen, die dazu neigen, Steine oder Kalziumoxalatsteine in den Nieren verursachen..
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Natriumoxalat. Nationales Zentrum für Informationen zur Biotechnologie. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Chai, W. und Liebman, M. (2005). Einfluss verschiedener Kochmethoden auf den Gehalt an pflanzlichem Oxalat. J. Agric. Food Chem. 2005, 53, 3027 & ndash; 3030. Von pubs.acs.org wiederhergestellt.
- Dagani, R. (1996). CFC-Zerstörungsreaktion. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Von pubs.acs.org wiederhergestellt.
- Sajjad, M. und Kim, K.S. (2016). Extraktion extrazellulärer polymerer Substanzen aus Belebtschlamm mit Natriumoxalat. Int. J. Environ. Sci. Technol. 13, 1697 & ndash; 1706 (2016). Von link.springer.com wiederhergestellt.
- Jeffrey, G.A. und Parry, G.S. (1954). Die Kristallstruktur von Natriumoxalat. J. Am. Chem. Soc. 1954, 76, 21, 5283-5286. Von pubs.acs.org wiederhergestellt.
- Okuwaki, A. et al. (1984). Herstellung von Oxalat durch Oxidation von Kohle mit Sauerstoff in einer konzentrierten Natriumhydroxidlösung. Ind. Eng. Chem. Prod. Res. Dev. 1984, 23, 648-651. Von pubs.acs.org wiederhergestellt.
- Hefter, G. et al. (2018). Löslichkeit von Natriumoxalat in konzentrierten Elektrolytlösungen. J Chem & Eng Data. 2018, 63, 3, 542 & ndash; 552. Von pubs.acs.org wiederhergestellt.
- The, K. I. (1992). Verfahren zur Herstellung von Oxalsäure und Natriumhydrogenoxalat aus rohem Natriumoxalat. UNS. Patent Nr. 5,171,887. 15. Dezember 1992. Von freepatentsonline.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.