
Struktur, Eigenschaften, Synthese und Verwendung der Salpetersäure (HNO3)
Das Salpetersäure Es ist eine anorganische Verbindung, die aus einer Stickstoffoxosäure besteht. Es wird als starke Säure angesehen, obwohl sein pKa (-1,4) dem pKa des Hydroniumions (-1,74) ähnlich ist. Ab diesem Zeitpunkt ist es vielleicht die "schwächste" von vielen bekannten starken Säuren..
Sein physikalisches Erscheinungsbild besteht aus einer farblosen Flüssigkeit, die sich bei Lagerung aufgrund der Bildung von Stickstoffgasen gelblich verfärbt. Seine chemische Formel lautet HNO3.

Es ist etwas instabil und zersetzt sich leicht, wenn es dem Sonnenlicht ausgesetzt wird. Darüber hinaus kann es durch Erhitzen vollständig zersetzt werden, wodurch Stickstoffdioxid, Wasser und Sauerstoff entstehen..
Das Bild oben zeigt etwas Salpetersäure, die in einem Messkolben enthalten ist. Es ist eine gelbe Färbung festzustellen, die auf eine teilweise Zersetzung hinweist.
Es wird zur Herstellung von anorganischen und organischen Nitraten sowie von Nitrosoverbindungen verwendet, die zur Herstellung von Düngemitteln, Sprengstoffen, Zwischenprodukten für Farbstoffe und verschiedenen organischen chemischen Verbindungen verwendet werden..
Diese Säure war den Alchemisten des 8. Jahrhunderts bereits bekannt, die sie "agua fortis" nannten. Der deutsche Chemiker Johan Rudolf Glauber (1648) entwarf eine Methode zu seiner Herstellung, die darin bestand, Kaliumnitrat mit Schwefelsäure zu erhitzen.
Es wird industriell nach der von Wilhelm Oswald (1901) entworfenen Methode hergestellt. Das Verfahren besteht im Allgemeinen aus der katalytischen Oxidation von Ammonium mit der sukzessiven Erzeugung von Stickoxid und Stickstoffdioxid unter Bildung von Salpetersäure..
In der Atmosphäre NOzwei Durch menschliche Aktivität erzeugte Reaktionen reagieren mit Wolkenwasser unter Bildung von HNO3. Während des sauren Regens fällt es dann zusammen mit Wassertropfen aus und frisst beispielsweise Statuen auf öffentlichen Plätzen weg..
Salpetersäure ist eine sehr giftige Verbindung, und eine kontinuierliche Exposition gegenüber ihren Dämpfen kann zu chronischer Bronchitis und chemischer Lungenentzündung führen..
Artikelverzeichnis
- 1 Struktur der Salpetersäure
- 1.1 Resonanzstrukturen
- 2 Physikalische und chemische Eigenschaften
- 2.1 Chemische Namen
- 2.2 Molekulargewicht
- 2.3 Aussehen
- 2.4 Geruch
- 2,5 Siedepunkt
- 2.6 Schmelzpunkt
- 2.7 Löslichkeit in Wasser
- 2.8 Dichte
- 2.9 Relative Dichte
- 2.10 Relative Dampfdichte
- 2.11 Dampfdruck
- 2.12 Zersetzung
- 2.13 Viskosität
- 2.14 Korrosion
- 2.15 Molare Verdampfungsenthalpie
- 2.16 Molaren Standardenthalpie
- 2.17 Standardmolare Entropie
- 2.18 Oberflächenspannung
- 2.19 Geruchsschwelle
- 2.20 Dissoziationskonstante
- 2.21 Brechungsindex (η / D)
- 2.22 Chemische Reaktionen
- 3 Synthese
- 3.1 Industrie
- 3.2 Im Labor
- 4 Verwendungen
- 4.1 Düngemittelproduktion
- 4.2 Industrie
- 4.3 Metallreiniger
- 4.4 Königswasser
- 4.5 Möbel
- 4.6 Reinigung
- 4.7 Fotografie
- 4.8 Andere
- 5 Toxizität
- 6 Referenzen
Salpetersäurestruktur
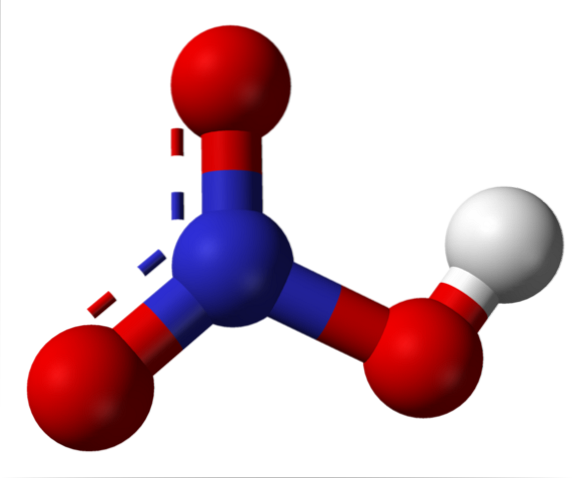
Das obere Bild zeigt die Struktur eines HNO-Moleküls.3 mit einem Modell von Kugeln und Balken. Das Stickstoffatom, die blaue Kugel, befindet sich in der Mitte, umgeben von einer Geometrie der trigonalen Ebene. Das Dreieck ist jedoch um einen seiner längsten Eckpunkte verzerrt.
Salpetersäuremoleküle sind dann flach. Die N = O-, N-O- und N-OH-Bindungen bilden die Eckpunkte des flachen Dreiecks. Bei genauer Betrachtung ist die N-OH-Bindung länger als die beiden anderen (wobei sich die weiße Kugel befindet, die das H-Atom darstellt)..
Resonanzstrukturen
Es gibt zwei Bindungen gleicher Länge: N = O und N-O. Diese Tatsache widerspricht der Valenzbindungstheorie, bei der vorausgesagt wird, dass Doppelbindungen kürzer sind als Einfachbindungen. Die Erklärung dafür liegt im Phänomen der Resonanz, wie im Bild unten zu sehen.

Beide Bindungen, N = O und N-O, sind daher hinsichtlich der Resonanz äquivalent. Dies wird im Strukturmodell grafisch dargestellt, indem eine gestrichelte Linie zwischen zwei O-Atomen verwendet wird (siehe Struktur)..
Wenn HNO deprotoniert ist3, das stabile Anionennitrat NO wird gebildet3-. Darin sind jetzt alle drei O-Atome an der Resonanz beteiligt. Dies ist der Grund, warum HNO3 hat einen hohen Säuregehalt von Bronsted-Lowry (H-Ionendonorspezies)+).
Physikalische und chemische Eigenschaften
Chemische Namen
-Salpetersäure
-Azotinsäure
-Wasserstoffnitrat
-Fortis Wasser.
Molekulargewicht
63,012 g / mol.
Aussehen
Farblose oder hellgelbe Flüssigkeit, die rotbraun werden kann.
Geruch
Scharfe, erstickende Eigenschaft.
Siedepunkt
181ºF bis 760 mmHg (83ºC).
Schmelzpunkt
-41,6 ºC.
Wasserlöslichkeit
Sehr löslich und mit Wasser mischbar.
Dichte
1,513 g / cm3 bei 20 ºC.
Relative Dichte
1,50 (bezogen auf Wasser = 1).
Relative Dampfdichte
2 oder 3 mal geschätzt (bezogen auf Luft = 1).
Dampfdruck
63,1 mmHg bei 25 ºC.
Zersetzung
Bei Einwirkung von Luftfeuchtigkeit oder Hitze kann es sich unter Bildung von Stickstoffperoxid zersetzen. Beim Erhitzen bis zur Zersetzung entsteht ein sehr giftiger Rauch aus Stickoxiden und Wasserstoffnitrat..
Salpetersäure ist nicht stabil, kann sich bei Kontakt mit Hitze und Sonneneinstrahlung zersetzen und emittiert Stickstoffdioxid, Sauerstoff und Wasser..
Viskosität
1.092 mPa bei 0 ° C und 0,617 mPa bei 40 ° C..
Korrosion
Es kann alle unedlen Metalle außer Aluminium und Chromstahl angreifen. Greift einige der verschiedenen Arten von Kunststoffen, Kautschuken und Beschichtungen an. Da es sich um eine ätzende und ätzende Substanz handelt, muss mit äußerster Vorsicht umgegangen werden.
Molare Verdampfungsenthalpie
39,1 kJ / mol bei 25 ºC.
Standard molare Enthalpie
-207 kJ / mol (298 ºF).
Standard molare Entropie
146 kJ / mol (298 ºF).
Oberflächenspannung
-0,04356 N / m bei 0 ° C.
-0,04115 N / m bei 20 ° C.
-0,0376 N / m bei 40 ° C.
Geruchsschwelle
-Geruchsarm: 0,75 mg / m3
-Hoher Geruch: 250 mg / m3
-Reizkonzentration: 155 mg / m3.
Dissoziationskonstante
pKa = -1,38.
Brechungsindex (η / D)
1,393 (16,5 ºC).
Chemische Reaktionen
Flüssigkeitszufuhr
-Kann feste Hydrate wie HNO bilden3∙ H.zweiO und HNO3H 3HzweiOder: "Salpetersäure".
Dissoziation in Wasser
Salpetersäure ist eine starke Säure, die in Wasser wie folgt schnell ionisiert:
HNO3 (l) + H.zweiO (l) => H.3ODER+ (ac) + NO3-
Salzbildung
Reagiert mit basischen Oxiden unter Bildung eines Nitratsalzes und von Wasser.
CaO (s) + 2 HNO3 (l) => Ca (NO3)zwei (ac) + H.zweiO (l)
Ebenso reagiert es mit Basen (Hydroxiden) und bildet ein Salz aus Nitrat und Wasser..
NaOH (aq) + HNO3 (l) => NaNO3 (ac) + H.zweiO (l)
Und auch mit Carbonaten und Säurecarbonaten (Bicarbonaten), die ebenfalls Kohlendioxid bilden.
N / AzweiCO3 (ac) + HNO3 (l) => NaNO3 (ac) + H.zweiO (l) + COzwei (G)
Protonierung
Salpetersäure kann sich auch als Base verhalten. Aus diesem Grund kann es mit Schwefelsäure reagieren.
HNO3 + 2HzweiSW4 <=> NICHTzwei+ + H.3ODER+ + 2HSO4-
Autoprotolyse
Salpetersäure wird autoprotolysiert.
2HNO3 <=> NICHTzwei+ + NICHT3- + H.zweiODER
Metalloxidation
Bei der Reaktion mit Metallen verhält sich Salpetersäure nicht wie starke Säuren, die mit Metallen reagieren, das entsprechende Salz bilden und Wasserstoff in gasförmiger Form freisetzen..
Magnesium und Mangan reagieren jedoch heiß mit Salpetersäure, genau wie die anderen starken Säuren..
Mg (s) + 2 HNO3 (l) => Mg (NO3)zwei (ac) + H.zwei (G)
Andere
Salpetersäure reagiert mit Metallsulfiten unter Bildung eines Nitratsalzes, Schwefeldioxids und Wassers..
N / AzweiSW3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SOzwei (g) + H.zweiO (l)
Außerdem reagiert es mit organischen Verbindungen und ersetzt eine Nitrogruppe durch Wasserstoff. Dies bildet die Grundlage für die Synthese explosiver Verbindungen wie Nitroglycerin und Trinitrotoluol (TNT)..
Synthese
Industriell
Es wird auf industrieller Ebene durch katalytische Oxidation von Ammonium nach dem von Oswald 1901 beschriebenen Verfahren hergestellt. Das Verfahren besteht aus drei Stufen oder Schritten.
Stufe 1: Oxidation von Ammonium zu Stickoxid
Ammoniak wird durch Luftsauerstoff oxidiert. Die Reaktion wird bei 800ºC und einem Druck von 6 bis 7 atm unter Verwendung von Platin als Katalysator durchgeführt. Ammoniak wird mit Luft mit dem folgenden Verhältnis gemischt: 1 Volumen Ammoniak pro 8 Volumen Luft.
4NH3 (g) + 50zwei (g) => 4NO (g) + 6HzweiO (l)
Bei der Reaktion entsteht Stickstoffmonoxid, das für die nächste Stufe in die Oxidationskammer gebracht wird..
Stufe 2. Oxidation von Stickoxid zu Stickstoffdioxid
Die Oxidation erfolgt durch den in der Luft vorhandenen Sauerstoff bei einer Temperatur unter 100 ºC.
2NO (g) + O.zwei (g) => 2NOzwei (G)
Stufe 3. Auflösung von Stickstoffdioxid in Wasser
In diesem Stadium tritt die Bildung von Salpetersäure auf.
4NOzwei + 2HzweiO + O.zwei => 4HNO3
Es gibt verschiedene Methoden zur Absorption von Stickstoffdioxid (NOzwei) im Wasser.
Unter anderem: NRzwei wird zu N dimerisiertzweiODER4 bei niedrigen Temperaturen und hohem Druck, um seine Löslichkeit in Wasser zu erhöhen und Salpetersäure zu produzieren.
3NzweiODER4 + 2HzweiO => 4HNO3 + 2NO
Die durch Oxidation von Ammoniak erzeugte Salpetersäure hat eine Konzentration zwischen 50 und 70%, die durch Verwendung von konzentrierter Schwefelsäure als Dehydratisierungsmittel auf 98% gebracht werden kann, wodurch die Salpetersäurekonzentration erhöht werden kann..
Im Labor
Thermische Zersetzung von Kupfer (II) -nitrat unter Bildung von Stickstoffdioxid und Sauerstoffgasen, die durch Wasser unter Bildung von Salpetersäure geleitet werden; wie bei der zuvor beschriebenen Oswald-Methode.
2Cu (NR3)zwei => 2CuO + 4NOzwei + ODERzwei
Reaktion eines Nitratsalzes mit H.zweiSW4 konzentriert. Die gebildete Salpetersäure wird vom H getrenntzweiSW4 durch Destillation bei 83 ºC (Siedepunkt von Salpetersäure).
KNO3 + H.zweiSW4 => HNO3 + KHSO4
Anwendungen
Düngemittelproduktion
60% der Salpetersäureproduktion werden zur Herstellung von Düngemitteln, insbesondere Ammoniumnitrat, verwendet.
Dies ist gekennzeichnet durch seine hohe Stickstoffkonzentration, einen der drei wichtigsten Pflanzennährstoffe, wobei Nitrat sofort von den Pflanzen verwendet wird. Währenddessen wird Ammoniak durch die im Boden vorhandenen Mikroorganismen oxidiert und als Langzeitdünger verwendet..
Industriell
-15% der Salpetersäureproduktion werden zur Herstellung von synthetischen Fasern verwendet.
-Es wird zur Herstellung von Salpetersäureestern und Nitroderivaten verwendet; wie Nitrocellulose, Acrylfarben, Nitrobenzol, Nitrotoluol, Acrylnitrile usw..
-Es kann organischen Verbindungen Nitrogruppen hinzufügen, und diese Eigenschaft kann zur Herstellung von Sprengstoffen wie Nitroglycerin und Trinitrotoluol (TNT) verwendet werden..
-Adipinsäure, eine Vorstufe von Nylon, wird in großem Maßstab durch Oxidation von Cyclohexanon und Cyclohexanol durch Salpetersäure hergestellt..
Metallreiniger
Salpetersäure ist aufgrund ihrer Oxidationskapazität sehr nützlich bei der Reinigung von Metallen, die in Mineralien vorhanden sind. Ebenso wird es zur Gewinnung von Elementen wie Uran, Mangan, Niob, Zirkonium und zur Ansäuerung von Phosphorgesteinen zur Gewinnung von Phosphorsäure verwendet..
Königliches Wasser
Es wird mit konzentrierter Salzsäure gemischt, um "Königswasser" zu bilden. Diese Lösung ist in der Lage, Gold und Platin aufzulösen, was ihre Verwendung bei der Reinigung dieser Metalle ermöglicht..
Möbel
Salpetersäure wird verwendet, um eine antike Wirkung in Möbeln aus Kiefernholz zu erzielen. Die Behandlung mit einer 10% igen Salpetersäurelösung erzeugt eine graugoldene Färbung im Holz der Möbel.
Reinigung
-Das Gemisch aus wässrigen Lösungen von Salpetersäure 5-30% und Phosphorsäure 15-40% wird zur Reinigung der bei den Melkarbeiten verwendeten Geräte verwendet, um die Rückstände der Niederschläge der Magnesium- und Calciumverbindungen zu entfernen.
-Es ist nützlich bei der Reinigung von Glaswaren, die im Labor verwendet werden.
Fotografie
-Salpetersäure wurde in der Fotografie verwendet, insbesondere als Zusatz zu Eisensulfatentwicklern im Nassplattenverfahren, um eine weißere Farbe in Ambrotypen und Farbtypen zu fördern..
-Es wurde verwendet, um den pH-Wert des Silberbades der Kollodiumplatten zu senken, wodurch das Erscheinungsbild eines Nebels, der die Bilder störte, verringert werden konnte.
Andere
-Aufgrund seiner Lösungsmittelkapazität wird es bei der Analyse verschiedener Metalle mittels Flammenatomabsorptionsspektrophotometrie und induktiv gekoppelter Plasmamassenspektrophotometrie verwendet..
-Die Kombination von Salpetersäure und Schwefelsäure wurde zur Umwandlung von gewöhnlicher Baumwolle in Cellulosenitrat (Salpetersäure) verwendet..
-Das Medikament Salcoderm zur äußerlichen Anwendung wird zur Behandlung von gutartigen Neubildungen der Haut (Warzen, Hühneraugen, Kondylome und Papillome) eingesetzt. Es besitzt Eigenschaften von Kauterisation, Schmerzlinderung, Reizung und Juckreiz. Salpetersäure ist der Hauptbestandteil der Arzneimittelformel.
-Rote rauchende Salpetersäure und weiße rauchende Salpetersäure werden als Oxidationsmittel für flüssige Raketentreibstoffe verwendet, insbesondere in der BOMARC-Rakete..
Toxizität
-Bei Hautkontakt kann es zu Hautverbrennungen, starken Schmerzen und Dermatitis kommen..
-Bei Kontakt mit den Augen kann es zu starken Schmerzen, Rissen und in schweren Fällen zu Hornhautschäden und Blindheit kommen..
-Das Einatmen der Dämpfe kann bei schwerer oder chronischer Exposition zu Husten, Atemnot, Nasenbluten, Kehlkopfentzündung, chronischer Bronchitis, Lungenentzündung und Lungenödem führen..
-Aufgrund seiner Einnahme gibt es Läsionen im Mund, Speichelfluss, intensiven Durst, Schluckschmerzen, starke Schmerzen im gesamten Verdauungstrakt und das Risiko einer Perforation der Wand derselben..
Verweise
- Wikipedia. (2018). Salpetersäure. Wiederhergestellt von: en.wikipedia.org
- PubChem. (2018). Salpetersäure. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Die Herausgeber der Encyclopaedia Britannica. (23. November 2018). Salpetersäure. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- Shrestha B. (s.f.). Eigenschaften von Salpetersäure und Verwendungen. Chem Guide: Tutorials zum Erlernen der Chemie. Wiederhergestellt von: chem-guide.blogspot.com
- Chemisches Buch. (2017). Salpetersäure. Wiederhergestellt von: Chemicalbook.com
- Imanol. (10. September 2013). Salpetersäureproduktion. Wiederhergestellt von: ingenieriaquimica.net


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.