
Natriumazid (NaN3) -Struktur, Eigenschaften, Verwendungen, Risiken

Das Natriumazid ist ein kristalliner anorganischer Feststoff, der durch das Natriumion Na gebildet wird+ und das Azidion N.3-. Seine chemische Formel lautet NaN3. Die Verbindung NaN3 ist das Natriumsalz der Salzsäure HN3. Das NaN3 ist ein farbloser bis weißer kristalliner Feststoff.
Obwohl es sich um eine sehr giftige Verbindung handelt, wurden Airbags, die sich bei Fahrzeugunfällen sofort aufblasen, am häufigsten eingesetzt. Es wird auch verwendet, um Notfallrutschen in Flugzeugen schnell aufzublasen. In beiden Fällen wird seine Verwendung jedoch aufgrund seiner Toxizität derzeit stark in Frage gestellt..

Es wird in chemischen Forschungslabors zur Synthese verschiedener Arten von Verbindungen und in biochemischen Labors für Studien mit Bakterien, Pilzen oder Säugetier- oder menschlichen Zellen verwendet.
In einigen Labors wird es zum Sterilisieren von Materialien oder Geräten verwendet, aber bestimmte Arten von Mikroorganismen widerstehen seiner bioziden Wirkung.
Es wurde auch in der Landwirtschaft verwendet, um Parasiten aus dem Boden zu entfernen, oder in der Holzindustrie, um zu verhindern, dass Kiefernholz mit Pilzen befleckt wird.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dichte
- 3.5 Löslichkeit
- 3.6 Dissoziationskonstanten
- 3.7 Chemische Eigenschaften
- 3.8 Biochemische Eigenschaften
- 4 Erhalten
- 5 Verwendungen
- 5.1 In Kraftfahrzeugen und Flugzeugen
- 5.2 In der chemischen Industrie
- 5.3 In der Landwirtschaft
- 5.4 Bei der Herstellung anderer chemischer Verbindungen
- 5.5 In der Sprengstoffindustrie
- 5.6 In biochemischen Labors
- 5.7 In verschiedenen Anwendungen
- 6 Risiken
- 7 Referenzen
Struktur
NaN-Natriumazid3 wird durch ein Natriumkation Na gebildet+ und ein Azidanion N.3-.
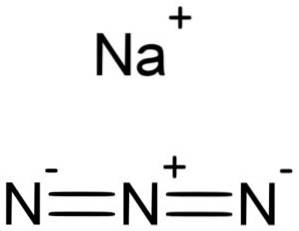
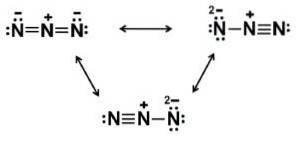
Das Azidion N.3- Es besteht aus 3 Stickstoffatomen (N), die durch kovalente Bindungen miteinander verbunden sind, die einfach, doppelt oder dreifach sein können, da die Elektronen zwischen den drei geteilt werden.
Das Anion hat eine lineare Struktur, dh die drei Stickstoffatome sind in einer geraden Linie angeordnet. Außerdem ist die Struktur symmetrisch.
Nomenklatur
- Natriumazid
- Natriumazid
Eigenschaften
Körperlicher Status
Farbloser bis weißer kristalliner Feststoff. Sechseckige Kristalle.
Molekulargewicht
65,01 g / mol
Schmelzpunkt
Es zersetzt sich bei 275 ºC.
Dichte
1,846 g / cm3 bei 20 ºC
Löslichkeit
Es ist in Wasser sehr gut löslich: 41,7 g / 100 ml bei 17 ºC. Es ist in Ethanol schwer löslich und in Ethylether unlöslich.
Dissoziationskonstanten
Hat einen pKb von 9.3. Wässrige Lösungen enthalten NH3, die bei 37 ºC schnell in die Umwelt entweicht.
Chemische Eigenschaften
Das NaN3 Es ist sehr korrosiv gegenüber Aluminium und mäßig gegenüber Kupfer und Blei.
Laut einer bestimmten Quelle ist Natriumazid nicht explosiv. Es zersetzt sich glatt und vollständig, wenn es auf 300 ° C oder mehr erhitzt wird, und bildet Natriummetall Na und Stickstoffgas N.zwei.
2 NaN3 → 2 Na + 3 N.zwei↑
Es ist ein Nitriermittel, dh es dient zur Stickstoffbildung oder Zugabe von Stickstoff zu anderen chemischen Verbindungen oder zur Oberfläche von Materialien wie Stahl..
Es ist in neutralem oder alkalischem Wasser in Abwesenheit von Licht stabil. Es wird durch Sonnenstrahlung zersetzt.
Biochemische Eigenschaften
Natriumazid hemmt ein Enzym namens Cytochromoxidase, das in den Mitochondrien von Zellen vorkommt und dabei maßgeblich an der Atmung und Energieerzeugung beteiligt ist.
Seine Wirkung verhindert die Erzeugung von ATP, einer Schlüsselverbindung bei zellulären Aktivitäten, und die Zelle verschlechtert sich oder beschädigt sich.
Bei Verschlucken, Einatmen oder Kontakt mit Natriumazid ist es sehr giftig und kann tödlich sein..
Erhalten
Ammoniak NH wird umgesetzt3 mit Natriummetall Na bei 350 ºC in einem geschlossenen Stahlbehälter, wobei Natriumamid NaNH erhalten wirdzwei.
Natriumamid NaNHzwei wird mit Distickstoffmonoxid N umgesetztzweiOder bei 230 ºC in einem Nickelreaktor und so entsteht ein Gemisch aus Natriumazid NaN3, Natriumhydroxid NaOH und Ammoniak NH3.
2 NaNHzwei + N.zweiO → NaN3 + NaOH + NH3
Es kann auch durch Umsetzen von Natriumamid mit Natriumnitrat NaNO erhalten werden3 bei 175 ºC:
3 NaNHzwei + Älterer Bruder3 → NaN3 + 3 NaOH + NH3
Zur Reinigung des Azids wird Wasser zu der Mischung gegeben, die Azidkristalle werden gewaschen und dann wird das Wasser verdampft. Das verbleibende kristalline Material ist Natriumazid NaN3 das dann bei 110 ºC getrocknet wird.
Anwendungen
In Kraftfahrzeugen und Flugzeugen
Natriumazid wird in der Automobilindustrie seit langem als Stickstoffgenerator zum schnellen Aufblasen von Airbags verwendet. Airbags) Sicherheit der Lenkräder von PKW und LKW bei einem Aufprall.
Es wurde auch in aufblasbaren Rutschen verwendet, die dazu dienen, schnell aus dem Inneren von Flugzeugen zu entkommen, die in Notsituationen gelandet sind..
In beiden Fällen beinhaltet der Mechanismus die Wirkung eines Funkens, um eine sofortige Reaktion zwischen Natriumazid und bestimmten Verbindungen zu erzeugen, wobei Stickstoffgas N erzeugt wirdzwei und Natriumoxid NazweiODER.
Bei dieser Anwendung ist die sofortige Freisetzung eines kalten und ungiftigen Gases erforderlich, daher ist Stickstoff das am besten geeignete Gas..

Diese Verwendung nimmt jedoch aufgrund der Toxizität von Natriumazid ab und stattdessen werden weniger toxische Verbindungen verwendet..
In der chemischen Industrie
Es wird als Verzögerer bei der Herstellung von Schwammkautschuk verwendet, um die Koagulation von Styrol- oder Butadienlatex zu verhindern, wenn diese in Kontakt mit Metallen gelagert werden, und um Nitrite in Gegenwart von Nitraten zu zersetzen.
In der Landwirtschaft
Es wurde in der Landwirtschaft eingesetzt: Als Biozid und Begasungsmittel ist es auch ein Nematizid, dh es wird auf Böden angewendet, um Nematoden zu eliminieren, bei denen es sich um Parasiten handelt, die einige Pflanzen befallen.

Es hat auch als Herbizid und zur Verhinderung von Fruchtfäule gewirkt.
Kürzlich die NaN3 wurde bei der Herstellung von Okra- oder Okra-Samen verwendet, um deren Beständigkeit gegen Staunässe zu beobachten.
Samen, auf die zuvor NaN aufgetragen wurde3 erzeugte Sämlinge, die den Hochwasserbedingungen besser standhielten als die unbehandelten, die Höhe der Pflanzen verbesserten, die Anzahl der Blätter erhöhten und die Anzahl der Wurzeln selbst bei überschüssigem Wasser erhöhten.
Bei der Herstellung anderer chemischer Verbindungen
Es wird als chemisches Reagenz bei der Synthese organischer Verbindungen verwendet, um beispielsweise viele organische Azide wie Tosylazid oder Azide von tertiären Alkylgruppen herzustellen, die für die chemische Synthese wichtig sind.
Es wird zur Herstellung von Salzsäure (HN) verwendet3) und reines Natrium (Na).
In der Sprengstoffindustrie
NaN-Natriumazid3 ist ein Zwischenprodukt bei der Herstellung von Sprengstoffen, da es zur Herstellung von Bleiazid Pb (N) verwendet wird3)zwei. Letzteres ist eine Verbindung, die explodiert, wenn sie mit Gewalt getroffen wird, weshalb sie beim Bau von Sprengvorrichtungen verwendet wird..

In biochemischen Labors
Natriumazid wird verwendet, wenn sterile Laborgeräte benötigt werden, da es verschiedene Arten von Mikroorganismen zerstören kann.
Es ist ein Biozidmittel. Einige Quellen weisen jedoch darauf hin, dass einige Arten von Bakterien gegen ihre Wirkung resistent sind..
Dies wird erreicht, indem die Sauerstoffbindungsstelle in der Cytochromoxidase blockiert wird, einem Enzym, das am Energieerzeugungsprozess einiger Mikroorganismen beteiligt ist..
Es wird in automatischen Blutzählern verwendet, auch bei der differenziellen Auswahl von Bakterien und zur Konservierung von Laborreagenzlösungen, da es das Wachstum bestimmter Mikroorganismen in diesen verhindert.
In verschiedenen Anwendungen
Natriumazid wird in der Holzindustrie verwendet, um das Wachstum brauner Pilzflecken auf Kiefernholz zu verhindern..
Es wurde auch in der japanischen Bierindustrie verwendet, um die Entwicklung eines Pilzes zu verhindern, der das Bier verdunkelt..
Risiken
Natriumazid ist eine toxische Verbindung, die ein Enzym hemmt, das für die Atmung und das Leben menschlicher und tierischer Zellen wichtig ist. Es wurde festgestellt, dass es die Zellen des Blutgefäßgewebes des Gehirns stark beeinträchtigen kann.
Die unmittelbare Wirkung nach Verschlucken, Einatmen oder Hautkontakt besteht darin, den Blutdruck gefährlich zu senken, was zum Tod führen kann. Daher muss mit großer Vorsicht umgegangen werden..
Es gibt Informationsquellen, die auf die Airbags von Fahrzeugen aufmerksam machen, die in Abfallbereichen zerstört werden.
In solchen Fällen könnten Personen, die sich der Gefahr nicht bewusst sind, auf die NaN-Ablagerungen zugreifen.3, Dies ist eine sehr giftige Verbindung. Darüber hinaus besteht die Gefahr einer Kontamination mit NaN3 Boden und Wasser.
Ebenso können Personen bei Unfällen, Kollisionen oder Fahrzeugbränden NaN ausgesetzt sein3 und dies kann vom medizinischen Personal, das an dem Notfall teilnimmt, unterschätzt oder unbekannt sein.
Es wurde auch auf die Exposition des Laborpersonals hingewiesen, das es verwendet.
Verweise
- Vwioko, E.D. et al. (2019). Natriumazid-Grundierung erhöht die Toleranz gegenüber Staunässe in Okra (Abelmoschus esculentus). Agronomy 2019, 9, 670. Von mdpi.com wiederhergestellt.
- Kho, D.T. et al. (2017). Tod von Endothelzellen der Blut-Hirn-Schranke gegen Natriumazid und seine gasförmigen Produkte. Biosensoren 2017, 7, 41. Von mdpi.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Natriumazid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Talavera, M. et al. (2019). Nematodenmanagement in den Erdbeerfeldern Südspaniens. Agronomy 2019, 9, 252. Von mdpi.com wiederhergestellt.
- Okano, T. et al. (1995). Mechanismus der Zellablösung von temperaturmodulierten, hydrophil-hydrophoben Polymeroberflächen. In The Biomaterials: Silver Jubilee Compendium. Von sciencedirect.com wiederhergestellt.
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. Band A22. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Chang, S. und Lamm, S.H. (2003). Auswirkungen der Natriumazidexposition auf die menschliche Gesundheit: Eine Literaturübersicht und -analyse. Int J Toxicol 2003, 22 (3): 175 & ndash; 86. Von ncbi.nlm.nih.gov wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.