
Hyposulfurous Acid Formeln, Eigenschaften und Verwendungen
Das schwefelhaltige Säure oder dithionöse Säure ist unbekannt, in reiner Form instabil, existiert nicht unabhängig und wurde in wässriger Lösung nicht nachgewiesen.
Theoretisch wäre es eine relativ schwache Säure, vergleichbar mit der schwefligen Säure H2SO3. Es sind nur seine Salze bekannt, die Dithionite, die stabile und starke Reduktionsmittel sind. Das Natriumsalz der Dithionsäure ist Natriumdithionit.

- Formeln
| dithionöse Säure | Dithionit-Anion | Natriumdithionit | |
| Formeln | H2S2O4 | S2O42− | Na2S2O4 |
- CAS: 20196-46-7 hyposchwefelhaltige (oder dithionöse) Säure
- CAS: 14844-07-6 hyposchwefelsäure (oder dithionöses Ion)
- CAS: 7775-14-6 Natriumdithionit (Natriumsalz der Dithionsäure)
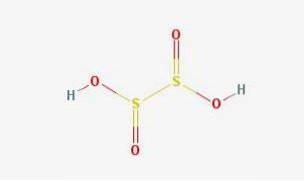
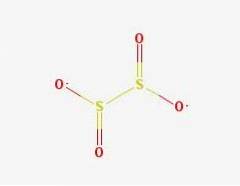
2D-Struktur
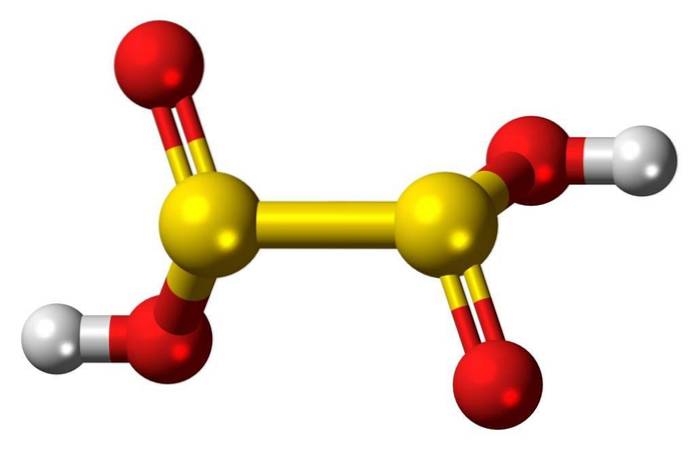
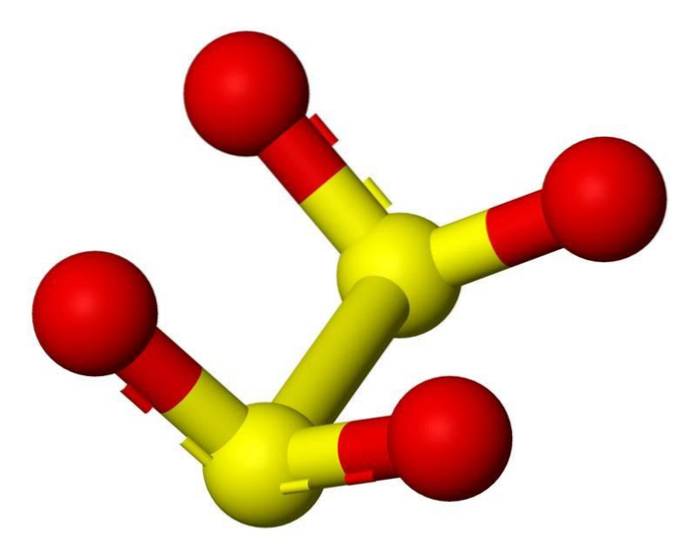
3D-Struktur
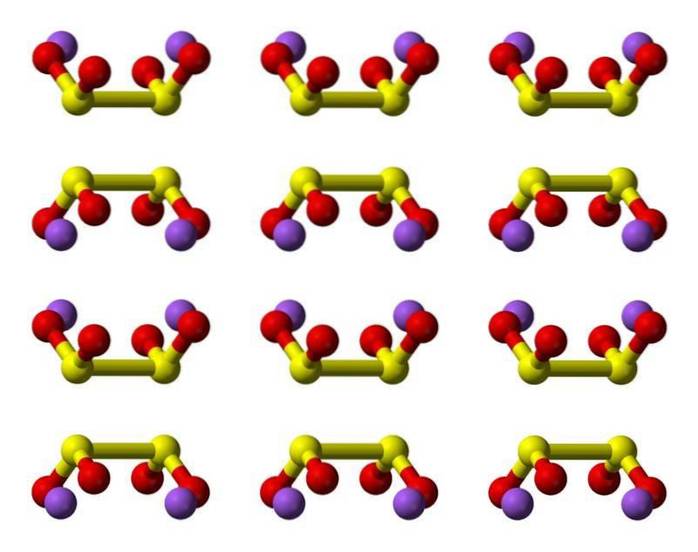
Eigenschaften
Physikalische und chemische Eigenschaften
| Dithionsäure | Dithionit-Anion | Natriumdithionit | |
| Aussehen: | . | . | Weißes bis cremefarbenes kristallines Pulver |
| . | . | Leichte Zitronenflocken | |
| Geruch: | . | . | Schwacher Schwefelgeruch |
| Molekulargewicht: | 130,132 g / mol | 128,116 g / mol | 174,096 g / mol |
| Siedepunkt: | . | . | Es zersetzt sich |
| Schmelzpunkt: | . | . | 52 ° C. |
| Dichte: | . | . | 2,38 g / cm³ (wasserfrei) |
| Wasserlöslichkeit | . | . | 18,2 g / 100 ml (wasserfrei, 20 ° C) |
Hyposchwefelsäure ist eine Schwefeloxosäure mit der chemischen Formel H2S2O4.
Schwefeloxosäuren sind chemische Verbindungen, die Schwefel, Sauerstoff und Wasserstoff enthalten. Einige von ihnen sind jedoch nur aus ihren Salzen bekannt (wie Hyposulfonsäure, Dithionsäure, Disulfidsäure und Schwefelsäure)..
Unter den strukturellen Eigenschaften der charakterisierten Oxosäuren haben wir:
- Tetraedrischer Schwefel bei Koordination mit Sauerstoff
- Brücken- und terminale Sauerstoffatome
- Terminal Peroxogruppen
- S = S Klemmen
- Zeichenfolgen von (-S-) n
Schwefelsäure ist die bekannteste und industriell wichtigste Schwefeloxidsäure.
Das Dithionitanion ([S2O4] 2-) ist ein Oxoanion (ein Ion mit der generischen Formel AXOY z-) von Schwefel, das formal von Dithionsäure abgeleitet ist.
Dithionit-Ionen werden sowohl sauer als auch alkalisch zu Thiosulfat und Bisulfit sowie zu Sulfit und Sulfid hydrolysiert:
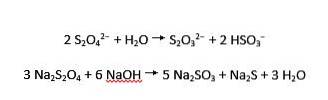
Das Natriumsalz der Dithionsäure ist Natriumdithionit (auch als Natriumhydrogensulfit bekannt)..
Natriumdithionit ist ein weißliches bis hellgelbes kristallines Pulver, das einen ähnlichen Geruch wie Schwefeldioxid aufweist..
Bei Kontakt mit Luft und Feuchtigkeit erwärmt es sich spontan. Diese Wärme kann ausreichen, um die umgebenden brennbaren Materialien zu entzünden..
Bei längerer Einwirkung von Feuer oder starker Hitze können Behälter aus diesem Material heftig platzen..
Es wird als Reduktionsmittel und als Bleichmittel verwendet. Es wird zum Bleichen von Zellstoff und zum Färben verwendet. Es wird auch verwendet, um die Nitrogruppe bei organischen Reaktionen zu einer Aminogruppe zu reduzieren..
Obwohl es unter den meisten Bedingungen stabil ist, zersetzt es sich in heißem Wasser und sauren Lösungen.
Es kann durch folgende Reaktion aus Natriumbisulfit erhalten werden:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ²
Luft- und Wasserreaktionen
Natriumdithionit ist ein brennbarer Feststoff, der sich bei Kontakt mit Wasser oder Wasserdampf langsam zersetzt und Thiosulfate und Bisulfite bildet..
Diese Reaktion erzeugt Wärme, die die Reaktion weiter beschleunigen oder das Verbrennen der umgebenden Materialien verursachen kann. Wenn das Gemisch eingeschlossen ist, kann die Zersetzungsreaktion zu einer Druckbeaufschlagung des Behälters führen, die heftig platzen kann. Wenn es in der Luft bleibt, oxidiert es langsam und erzeugt giftige Schwefeldioxidgase.
Feuergefahr
Natriumdithionit ist ein brennbares und brennbares Material. Kann sich bei Kontakt mit feuchter Luft oder Feuchtigkeit entzünden. Es kann schnell mit Fackeleffekt brennen. Kann bei Kontakt mit Wasser heftig oder explosionsartig reagieren.
Kann sich bei Erwärmung oder Brand explosionsartig zersetzen. Es kann nach dem Löschen des Feuers wieder entzündet werden. Abfluss kann eine Brand- oder Explosionsgefahr verursachen. Behälter können beim Erhitzen explodieren.
Gefahr für die Gesundheit
Bei Kontakt mit Feuer erzeugt Natriumdithionit reizende, ätzende und / oder giftige Gase. Das Einatmen von Zersetzungsprodukten kann zu schweren oder tödlichen Verletzungen führen. Kontakt mit der Substanz kann schwere Haut- und Augenverbrennungen verursachen. Abfluss von der Brandbekämpfung kann zu Umweltverschmutzung führen.
Anwendungen
Das Dithionit-Ion wird häufig in Verbindung mit einem Komplexbildner (z. B. Zitronensäure) verwendet, um Eisen (III) -oxyhydroxid zu löslichen Eisen (II) -Verbindungen zu reduzieren und amorphe eisenhaltige Mineralphasen (III) bei der Bodenanalyse zu entfernen (selektive Extraktion) ).
Dithionit erhöht die Löslichkeit von Eisen. Dank der starken Affinität des Dithionit-Ions zu zwei- und dreiwertigen Metallkationen wird es als Chelatbildner eingesetzt..
Die Zersetzung von Dithionit erzeugt reduzierte Schwefelspezies, die für die Korrosion von Stahl und Edelstahl sehr aggressiv sein können..
Unter den Anwendungen von Natriumdithionit haben wir:
In der Industrie
Diese Verbindung ist ein wasserlösliches Salz und kann als Reduktionsmittel in wässrigen Lösungen verwendet werden. Es wird als solches in einigen industriellen Färbeverfahren verwendet, hauptsächlich solchen, die Schwefelfarbstoffe und Küpenfarbstoffe betreffen, bei denen ein wasserunlöslicher Farbstoff zu einem wasserlöslichen Alkalimetallsalz (zum Beispiel dem Indigofarbstoff) reduziert werden kann..
Die reduzierenden Eigenschaften von Natriumdithionit entfernen auch überschüssiges Farbstoff, Restoxid und unerwünschte Pigmente und verbessern so die Gesamtfarbqualität..
Natriumdithionit kann auch zur Wasseraufbereitung, Gasreinigung, Reinigung und Extraktion verwendet werden. Es kann auch in industriellen Prozessen als Sulfonierungsmittel oder Natriumionenquelle verwendet werden.
Neben der Textilindustrie wird diese Verbindung in Branchen verwendet, die mit Leder, Lebensmitteln, Polymeren, Fotografie und vielen anderen zu tun haben. Wird auch als Bleichmittel bei organischen Reaktionen verwendet.
In den Biowissenschaften
Natriumdithionit wird häufig in physiologischen Experimenten verwendet, um das Redoxpotential von Lösungen zu verringern..
In den Geowissenschaften
Natriumdithionit wird häufig in bodenchemischen Experimenten verwendet, um die Menge an Eisen zu bestimmen, die nicht in primären Silikatmineralien enthalten ist..
Sicherheit und Risiken
Gefahrenhinweise des global harmonisierten Systems zur Einstufung und Kennzeichnung von Chemikalien (GHS)
Das global harmonisierte System zur Einstufung und Kennzeichnung von Chemikalien (GHS) ist ein international vereinbartes System, das von den Vereinten Nationen geschaffen wurde und die verschiedenen in verschiedenen Ländern verwendeten Klassifizierungs- und Kennzeichnungsstandards durch weltweit einheitliche Kriterien ersetzen soll..
Die Gefahrenklassen (und das entsprechende GHS-Kapitel), die Klassifizierungs- und Kennzeichnungsstandards sowie die Empfehlungen für Natriumdithionit lauten wie folgt (Europäische Chemikalienagentur, 2017; Vereinte Nationen, 2015; PubChem, 2017):



Verweise
- Benjah-bmm27 (2006). Ein Ball-and-Stick-Modell des Dithionit-Ions [Bild], wiederhergestellt von wikipedia.org.
- Y. Drozdova, R. Steudel, R. H. Hertwig, W. Koch & T. Steiger (1998). Strukturen und Energien verschiedener Isomere der Dithionsäure H2S2O4 und ihres Anions HS2O4-1. The Journal of Physical Chemistry A, 102 (6), 990-996. Wiederhergestellt von: mycrandall.ca
- Europäische Chemikalienagentur (ECHA). (2017). Zusammenfassung der Klassifizierung und Kennzeichnung. Harmonisierte Einstufung - Anhang VI der Verordnung (EG) Nr. 1272/2008 (CLP-Verordnung). Natriumdithionit, Natriumhydrogensulfit. Abgerufen am 2. Februar 2017 von: echa.europa.eu
- Jynto (Diskussion), (2011). Dithionsäure-3D-Bälle [Bild] Wiederhergestellt von: https://en.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Probe von Natriumdithionit [Bild] Wiedergewonnen von: wikipedia.org.
- Mills, B. (2009). Natriumdithionit-xtal-1992-3D-Kugeln [Bild] Wiederhergestellt von: wikipedia.org.
- Vereinte Nationen (2015). Global harmonisiertes System zur Klassifizierung und Kennzeichnung von Chemikalien (GHS) Sechste überarbeitete Ausgabe. New York, EU: Veröffentlichung der Vereinten Nationen. Wiederhergestellt von: unece.orgl
- Nationales Zentrum für Informationen zur Biotechnologie. PubChem Compound Database. (2017). Dithionit. Bethesda, MD, EU: Nationalbibliothek für Medizin. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Nationales Zentrum für Informationen zur Biotechnologie. PubChem Compound Database. (2017). Dithionsäure. Bethesda, MD, EU: Nationalbibliothek für Medizin. Wiederhergestellt von: nih.gov.
- Nationales Zentrum für Informationen zur Biotechnologie. PubChem Compound Database. (2017). Natriumdithionit. Bethesda, MD, EU: Nationalbibliothek für Medizin. Wiederhergestellt von: nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Chemisches Datenblatt. Natriumdithionit. Silver Spring, MD. EU; Wiederhergestellt von: comeochemicals.noaa.gov
- PubChem, (2016). Dithionit [Bild] Wiederhergestellt von: nih.gov.
- PubChem, (2016). Dithionit [Bild] Wiederhergestellt von: nih.gov.
- PubChem, (2016). Dithionsäure [Bild] Wiedergewonnen aus: nih.gov.
- Wikipedia. (2017). Dithionit. Abgerufen am 2. Februar 2017 von: wikipedia.org.
- Wikipedia. (2017). Dithionsäure. Abgerufen am 2. Februar 2017 von: wikipedia.org.
- Wikipedia. (2017). Oxyanion. Abgerufen am 2. Februar 2017 von: wikipedia.org.
- Wikipedia. (2017). Natriumdithionit. Abgerufen am 2. Februar 2017 von: wikipedia.org.
- Wikipedia. (2017). Schwefeloxosäure. Abgerufen am 2. Februar 2017 von: wikipedia.org.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.