
Struktur, Eigenschaften, Verwendungen von Natriumchlorid (NaCl)
Das Natriumchlorid, Es wird auch als Kochsalz oder Speisesalz bezeichnet und ist ein binäres anorganisches Salz des Alkalimetalls Natrium und des Halogenchlors. Es ist der größte Bestandteil von essbarem Salz und seine mineralische Form ist als Halit bekannt. Seine Summenformel lautet NaCl und beschreibt das stöchiometrische Verhältnis seiner Ionen (Na+ Cl-) und nicht das eines diskreten Moleküls (Na-Cl)
Natriumchlorid ist ein weißer kristalliner Feststoff, der durch die Kombination von Natrium, einem silberweißen Metall, das heftig mit Wasser reagiert, und dem Element Chlor, einem giftigen, ätzenden und hellgrünen Gas, gebildet wird..

Ein Teil der NaCl-Kristalle ist im oberen Bild dargestellt. Wie ist es möglich, dass zwei Elemente so gefährlich sind wie Na und Clzwei, kann ein essbares Salz gebildet werden? Erstens lautet die chemische Gleichung für ihre Bildung:
2Na (s) + Clzwei(g) => 2NaCl (s)
Die Antwort liegt in der Art der Bindung in NaCl. Da es ionisch ist, sind die Eigenschaften von Na+ und Cl- unterscheiden sich diagonal von ihren neutralen Atomen.
Natrium ist ein lebenswichtiges Element, jedoch in seiner ionischen Form. Dann ein+ ist das wichtigste extrazelluläre Kation mit einer Konzentration von ungefähr 140 mÄq / l und zusammen mit seinen Begleitanionen Cl- und das HCO3- (Bicarbonat) sind hauptsächlich für den Wert der Osmolarität und des extrazellulären Volumens verantwortlich.
Weiterhin ist das Na+ Es ist verantwortlich für die Erzeugung und Leitung des Nervenimpulses in den neuronalen Axonen sowie für die Initiierung der Muskelkontraktion.
NaCl wird seit der Antike verwendet, um Lebensmittel zu würzen und Fleisch zu konservieren, da es Bakterien abtöten und Verderb verhindern kann.
Es ist auch für die Herstellung von Natriumhydroxid (NaOH) und molekularem Chlor (Clzwei), Reaktion von NaCl mit Wasser unter Hydrolyse:
2HzweiO (1) + 2 NaCl (s) => 2 NaOH (aq) + Clzwei(g) + H.zwei(G)
In der Kathode (-) akkumulieren die H.zwei (g) und NaOH. Währenddessen sammelt sich in der Anode (+) das Cl anzwei (G). Natriumhydroxid wird bei der Herstellung von Seifen und Chlor bei der Herstellung von PVC-Kunststoff verwendet.
Artikelverzeichnis
- 1 Struktur von Natriumchlorid
- 1.1 Einheitszelle
- 2 Eigenschaften
- 2.1 Summenformel
- 2.2 Molekulargewicht
- 2.3 Physikalische Beschreibung
- 2.4 Farbe
- 2.5 Geschmack
- 2.6 Siedepunkt
- 2.7 Schmelzpunkt
- 2.8 Löslichkeit in Wasser
- 2.9 Löslichkeit in organischen Lösungsmitteln
- 2.10 Dichte
- 2.11 Dampfdruck
- 2.12 Stabilität
- 2.13 Zersetzung
- 2.14 Viskosität
- 2.15 Korrosion
- 2,16 pH
- 3 Verwendungen
- 3.1 In Lebensmitteln
- 3.2 Industrielle Anwendungen
- 3.3 Zu Hause
- 3.4 Andere Verwendungen
- 3.5 Therapeutische Anwendungen
- 4 Toxizität
- 4.1 Verschlucken
- 4.2 Reizung und körperlicher Kontakt
- 5 Referenzen
Struktur von Natriumchlorid
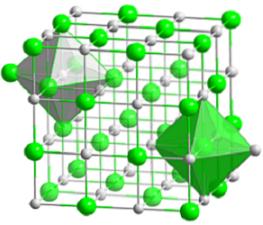
Das obere Bild zeigt die kompakte kubische Struktur von Natriumchlorid. Die voluminösen grünen Kugeln entsprechen den Cl-Anionen-, während die weißen zu den Na-Kationen+. Beachten Sie, wie der NaCl-Kristall aus einem Netzwerk von Ionen besteht, die durch ihre elektrostatischen Wechselwirkungen im Verhältnis 1: 1 angeordnet sind..
Obwohl im Bild Balken dargestellt sind, sind die Bindungen nicht kovalent, sondern ionisch. Die Verwendung von Balken ist nützlich, wenn die Koordinationsgeometrie um ein Ion herum angezeigt wird. Zum Beispiel im Fall von NaCl jedes Na+ ist umgeben von sechs Cl- (weißes Oktaeder) und jedes Cl- von sechs Na+ (grünes Oktaeder).
Daher hat es eine Koordination (6,6), deren Zahlen angeben, wie viele Nachbarn jedes Ion umgeben. Die Zahl rechts zeigt die Nachbarn des Na an+, während der links die des Cl-.
Andere Darstellungen lassen die Verwendung von Balken weg, um die oktaedrischen Löcher in der Struktur hervorzuheben, die sich aus dem Zwischenraum zwischen sechs Cl-Anionen ergeben.- (oder Na-Kationen+) verpackt. Diese Anordnung wird in anderen mono- (MX) oder mehratomigen anorganischen Salzen beobachtet und als Edelsteinsalz bezeichnet.
Einheitszelle
Die Einheitszelle aus Steinsalz ist kubisch, aber welche Würfel repräsentieren sie genau im obigen Bild? Die Oktaeder geben die Antwort. Beide bedecken eine Gesamtzelle aus vier kleinen Würfeln.
Diese Würfel haben Teile der Ionen an ihren Eckpunkten, Kanten und Flächen. Bei genauem Hinsehen ein Na-Ion+ es befindet sich in der Mitte und zwölf davon an den Rändern. Ein Ion an einer Kante kann von vier Würfeln geteilt werden. Es gibt also 4 Na-Ionen+ (12 × 1/4 + 1 = 4).
Für Cl-Ionen-, Acht befinden sich an den Eckpunkten und sechs an den Rändern. Da sich die an den Eckpunkten positionierten Ionen den Raum mit acht anderen Würfeln und an den Rändern mit sechs teilen, haben wir 4 Cl-Ionen- (8 × 1/8 + 6 × 1/2 = 4).
Das obige Ergebnis wird wie folgt interpretiert: In der Elementarzelle von NaCl befinden sich vier Na-Kationen+ und vier Cl-Anionen-;; Anteil, der mit der chemischen Formel übereinstimmt (a Na+ für jeden Cl-).
Eigenschaften
Molekularformel
NaCl.
Molekulargewicht
58,44 g / mol.
Physische Beschreibung
Ein kristalliner Feststoff.
Farbe
Transparente farblose Kristalle oder weißes kristallines Pulver.
Geschmack
Salzig.
Siedepunkt
775 mmHg.
1.465 ºC.
Schmelzpunkt
800,7 ºC (1.474 ºF).
Sowohl der Siedepunkt als auch der Schmelzpunkt spiegeln die Wärme wider, die zur Überwindung der Kristallgitterenergie erforderlich ist. Daher bestätigen diese Messungen den ionischen Charakter von NaCl..
Wasserlöslichkeit
Größer oder gleich 100 mg / ml bei 68ºF.
36,0 g / 100 ml bei 25 ° C..
Es ist in der Tat ein hygroskopisches Salz, das Feuchtigkeit aus der Umgebung zurückhält.
Löslichkeit in organischen Lösungsmitteln
0,065 g / 100 ml Ethanol bei 25 ° C; 10 g / 100 g Glycerin bei 25 ° C; 2,15 g / 100 ml flüssiges Ammoniak bei 40 ° C; 1,4 g / 100 ml Methanol bei 25 ° C; 7,15 g / 100 Ethylenglykol bei 25 ° C und 5,21 g / 100 g Ameisensäure bei 25 ° C..
Dichte
2,165 g / cm3 bei 77 ºC.
Dampfdruck
1 mmHg bei 1.589ºF.
Stabilität
Stabil unter empfohlenen Lagerbedingungen.
Zersetzung
Beim Erhitzen auf hohe Temperaturen zersetzt es sich und emittiert Salzsäure- und Dinatriumoxiddämpfe..
Viskosität
Viskosität gesättigter Lösungen 1,93 mPa-s.
Korrosion
Es ist ätzend für viele Metalle.
pH
6,7 bis 7,3 in wässriger Lösung.
Anwendungen
Im Essen
-Natriumchlorid wird seit der Antike verwendet, um den Geschmack von Lebensmitteln zu verbessern und zu konservieren. Das Salzen von Fleisch ist ein Weg, um es vor bakteriellen Einflüssen zu schützen, da es den Proteinabbau verzögert.
-Andererseits erhöht Salz die Osmolarität um das Fleisch herum, was die Absorption des Wassers der Bakterien durch Osmose bewirkt und deren Beseitigung bewirkt.
Industrielle Anwendungen
Nahrungsmittelindustrie
-In der Lebensmittelindustrie wird Salz als Geschmacksverstärker, Fermentationskontrolladditiv, Texturkontrollmittel und Farbentwickler verwendet. Zum Beispiel wird Salz hinzugefügt, um die Farbe in Speck, Schinken und anderen Fleischprodukten hervorzuheben..
-Salz dient als Bindemittel bei der Herstellung von Würstchen. Trägt zur Bildung eines Bindemittelgels bei, das aus Fleisch, Fett und Feuchtigkeit besteht.
-Bei der Mehlverarbeitung für die Brotherstellung wird während des Backens Salz hinzugefügt, um die Sauerteigrate des Brotteigs zu steuern. Es wird auch zur Stärkung von Gluten und als Geschmacksverstärker sowie zum Füllen von Backwaren verwendet.
-Es wird zur Herstellung von Frühstückszerealien, gemischten oder zubereiteten Mehlen, Pommes Frites, Hunde- und Katzenfutter usw. verwendet..
Synthese von Chemikalien
-Natriumchlorid wird als Rohstoff bei der Herstellung von Natriumhydroxid und Chlor verwendet, die wiederum in vielen chemischen Industrien nützlich sind.
-Salz wird bei der Verarbeitung verschiedener Metalle verwendet, beispielsweise Aluminium, Kupfer, Stahl und Vanadium. Es wird auch zur Herstellung von Natriumchlorat verwendet, das später bei der Synthese von Chlordioxid, einem Bleichmittel auf Sauerstoffbasis, verwendet wird. Chlordioxid ist weniger umweltschädlich als andere Bleichmittel.
In der Lederindustrie
-Das Salz wird verwendet, um die bakterielle Wirkung in der Haut zu hemmen und die Rehydratation zu unterstützen.
In der Textilindustrie
-Salz wird als Beizmittel beim Färben von Stoffen verwendet. Es wird als Solespülung verwendet, um organische Verunreinigungen zu entfernen und eine positive Ladung auf der Oberfläche von Geweben zu erzeugen, die das Verbinden von negativ geladenen Farbstoffen ermöglicht.
In der Ölindustrie
-Bei der Öl- und Gasexploration ist Salz ein wichtiger Bestandteil von Bohrflüssigkeiten. Es wird zum Ausflocken und Erhöhen der Dichte von Bohrflüssigkeiten verwendet, wodurch die hohen Gasdrücke in den zu erreichenden Bohrlöchern überwunden werden können. Zusätzlich hält das Salz die Sättigung der Bohrflüssigkeit aufrecht.
-Salz hilft, den Boden zu verdichten, auf dem Straßen gebaut werden. Reduziert die unterirdische Verschiebung, die durch Änderungen der Luftfeuchtigkeit und den Autoverkehr verursacht wird.
Im Haus
Salz wurde durch Einreiben von Reinigungsflächen, Töpfen und Pfannen verwendet. Auch zur Vorbeugung von Schimmel und als Fleckenentferner. Es wird auch in vielen Marken von Shampoo und Zahnpasta verwendet..
Andere Verwendungen
Auf den Straßen
-In Erwartung von Schneefall sind die Straßen mit Salzlake bedeckt, wodurch verhindert wird, dass sich Eis an der Straßenoberfläche festsetzt. Zum Auftauen wird eine Mischung aus Salzlösung und Salz verwendet, und manchmal werden andere chemische Komponenten wie Magnesium oder Calciumchlorid zugesetzt. Die Verwendung von Salz und Salzlösung ist bei Temperaturen unter -10 ºC nicht wirksam.
Die Zugabe von Salz führt zu einer Abnahme des kryoskopischen Punktes, einer kolligativen Eigenschaft der Lösungen, wodurch die Eisbildung in gewisser Weise behindert wird..
-Aufgrund seines hygroskopischen Zustands wird Salz als billiges Trockenmittel verwendet.
In Harzen zum Erweichen von Wasser verwendet
Hartes Wasser enthält Calcium- und Magnesiumionen, die die Wirkung von Seife behindern und Ablagerungen von alkalischen Materialien auf verschiedenen Geräten und Rohren verursachen. Bei der Wasserenthärtung werden Ionenaustauscherharze verwendet. Salz wird zur Herstellung und Regeneration von Harzen verwendet.
In Feuerlöschern
Natriumchlorid wird in Feuerlöschern verwendet, um Brände zu bekämpfen, in denen brennbare Metalle wie Magnesium-, Kalium-, Natrium- und NK-Legierungen vorhanden sind..
Salz wirkt als Kühlkörper und bildet auch eine Kruste, die den Sauerstoffzugang zum Feuer einschränkt..
In den Gläsern
Natriumchloridkristalle werden in optischen Komponenten wie Fenstern und Prismen verwendet, insbesondere für Infrarotlicht. Da das Salz jedoch sehr hygroskopisch ist, entsteht eine Art Frost, der die Linsen bedeckt. Aus diesem Grund wurden Natriumchloridlinsen durch Zinkselenidlinsen (ZnSe) ersetzt..
Therapeutische Anwendungen
Machen Sie den Mangel an Salzen im Körper wieder wett
-Wenn es eine körperliche Erschöpfung von Na gibt+, muss ersetzt werden, um die extrazelluläre Osmolarität, Nervenleitung und Muskelkontraktion aufrechtzuerhalten.
-NaCl wird zur Behandlung und Vorbeugung von Natrium- und Chlormangel verwendet, der durch übermäßiges Schwitzen bei hohen Temperaturen entsteht. Es wird auch bei einer übermäßigen Diurese oder einer übermäßigen Einschränkung der Salzaufnahme angewendet.
-Die parenterale Abgabe einer 045% igen NaCl-Lösung wird zur Behandlung von hyperosmolarem Diabetes verwendet. Es erfüllt eine rehydrierende Funktion und dient zur Beurteilung des Nierenfunktionsstatus.
-Injektionen von hypertonischen Lösungen mit einer NaCl-Konzentration von mehr als 0,9% w / v,
-Sie werden bei starker Na-Erschöpfung eingesetzt+, eine Wiederherstellung des essentiellen Ions sein. Diese Hyponatriämie kann die Folge einer Behandlung mit freien Elektrolyten oder mit einer Konzentration von Na sein+.
Hyponatriämie kann auch durch übermäßige Wasseraufnahme verursacht werden, die nicht durch eine unzureichende Nierenfunktion kontrolliert wird..
Bei unkonventionellen Behandlungen und Anwendungen
-NaCl-Inhalationslösungen werden verwendet, um die während des Zerstäubungsprozesses verwendeten Arzneimittel zu verdünnen. Es wird auch zur Trachealspülung und Spülung verwendet. 0,9% ige Kochsalzlösung für Nasensprays.
-20% ige NaCl-Lösungen werden für die intraamniotische transabdominale Installation verwendet, wodurch im zweiten Schwangerschaftstrimester eine späte Abtreibung induziert wird..
-Natriumchlorid kann als lokales Antiseptikum verwendet werden. Dank seiner osmotischen Kapazität ist es in der Lage, ein breites Spektrum von Viren und Bakterien in einem nicht angespornten Zustand zu dehydrieren. Daher wird es als schmerzhaftes Antiseptikum zur Desinfektion von Wunden verwendet.
Toxizität
Verschlucken
Es wirkt sich nur dann gesundheitsschädlich aus, wenn die Aufnahme hoch und über einen längeren Zeitraum ist. Unter diesen Umständen würde eine Hypernatriämie mit der daraus resultierenden Zunahme des extrazellulären Volumens auftreten, die zu einer arteriellen Hypertonie führen würde..
Reizung und körperlicher Kontakt
Es hat nur dann eine toxische Wirkung, wenn die Inhalation sehr hoch ist. Übermäßiger Kontakt mit der Haut kann dazu führen, dass sie trocken ist. Schließlich verursacht es eine vorübergehende Reizung beim Kontakt mit den Augen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Ausgabe, S. 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Learning, S. 482-483.
- Natriumchlorid. (2018). Natriumchlorid: Vorteile, Verwendung, Eigenschaften, Risiken. Entnommen aus: Natriumchlorid.org
- PubChem. (2018). Natriumchlorid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Natriumchlorid. Entnommen aus: en.wikipedia.org
- Amerikanische Elemente. (2018). Natriumchlorid. Entnommen aus: americanelements.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.