
Chemische Struktur, Eigenschaften, Herstellung, Verwendung von Borsäure
Das Borsäure ist eine anorganische Verbindung, deren chemische Formel H ist3BO3. Es besteht aus einem weißen oder farblosen Feststoff. Es ist eine schwache Säure, die in wässriger Lösung je nach Konzentration einen pH-Wert zwischen 3,8 und 4,8 erzeugt. Es ist in kaltem Wasser schwer löslich und in heißem Wasser mäßig löslich..
Borsäure wurde 1702 von Wilhelm Homberg (1652-1713) entdeckt, der Borax mit Schwefelsäure behandelte und eine Lösung mit medizinischer Wirkung erhielt, die den Namen Hombergs Beruhigungswasser erhielt..

Es wird jedoch auch darauf hingewiesen, dass Homberg die Borsäure durch Zugabe von Wasser zum Borax und Erhitzen der Lösung bis zum Verdampfen herstellte, wodurch die Borsäurekristalle im Sediment zurückblieben..
Diese Säure ist eine sehr nützliche Verbindung, die zahlreiche Anwendungen in Industrie und Medizin hat, auch als Insektizid, Holzschutzmittel, Feuerhemmer verwendet wird und Bestandteil einer pH-Pufferlösung ist..
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 Kristalle
- 2 Eigenschaften
- 2.1 Namen
- 2,2 Molmasse
- 2.3 Aussehen
- 2.4 Geruch
- 2.5 Geschmack
- 2.6 Schmelzpunkt
- 2.7 Siedepunkt
- 2.8 Löslichkeit in Wasser
- 2.9 Löslichkeit in anderen Lösungsmitteln
- 2.10 Octanol / Wasser-Verteilungskoeffizient
- 2.11 Säure (pKa)
- 2,12 pH
- 2.13 Dampfdruck
- 2.14 Stabilität
- 2.15 Zersetzung
- 2.16 Reaktivität
- 3 Vorbereitung
- 4 Verwendungen
- 4.1 In der Industrie
- 4.2 In der Medizin
- 4.3 Insektizid
- 4.4 Erhaltung
- 4,5 pH-Puffer
- 4.6 Kernreaktoren
- 4.7 Landwirtschaft
- 5 Gegenanzeigen
- 6 Referenzen
Chemische Struktur
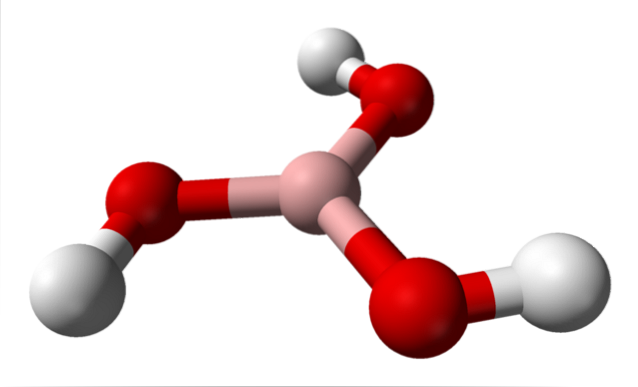
Im oberen Bild haben wir das Molekül selbst von H.3BO3. Beachten Sie, dass Wasserstoffatome, dargestellt durch weiße Kugeln, nicht an das zentrale Boratom gebunden sind, wie die chemische Formel vermuten lässt. sondern zu Sauerstoffatomen, dargestellt durch rote Kugeln.
Daher ist eine bequemere, wenn auch weniger verwendete Formel für Borsäure B (OH)3, Dies zeigt an, dass sein Säuregehalt auf H-Ionen zurückzuführen ist+ aus ihren OH-Gruppen freigesetzt. Das Molekül B (OH)3 hat eine trigonale Ebenengeometrie, wobei sein Boratom eine chemische Hybridisierung sp aufweistzwei.
Das B (OH)3 Es ist ein hochkovalentes Molekül, da der Elektronegativitätsunterschied zwischen dem Boratom und Sauerstoff nicht sehr groß ist; Die B-O-Bindungen sind also im Wesentlichen kovalent. Beachten Sie auch, dass die Struktur dieses Moleküls der eines Spinners ähnelt. Kann es sich auf die gleiche Weise um seine eigene Achse drehen??
Kristalle
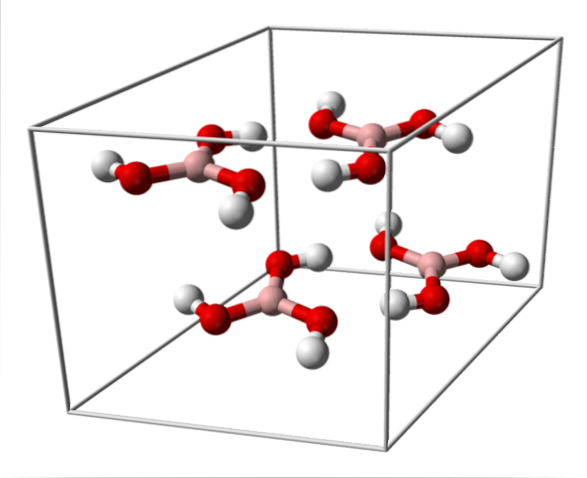
Das obere Bild zeigt die Einheitszelle, die der triklinen Kristallstruktur für Borsäure entspricht, die unter bestimmten Synthesebedingungen die kompakte hexagonale Struktur annehmen kann. Es ist zu beachten, dass es vier Moleküle pro Einheitszelle gibt und dass sie in zwei Schichten A und B abwechselnd angeordnet sind (sie sind nicht übereinander gelegt)..
Aufgrund der Symmetrie und Orientierung der B-OH-Bindungen kann davon ausgegangen werden, dass das B (OH)3 ist unpolar; Die Existenz intermolekularer Wasserstoffbrückenbindungen ändert jedoch die Geschichte. Jedes Molekül von B (OH)3 drei dieser Brücken mit insgesamt sechs Dipol-Dipol-Wechselwirkungen zu geben oder zu empfangen, wie im folgenden Bild gezeigt:
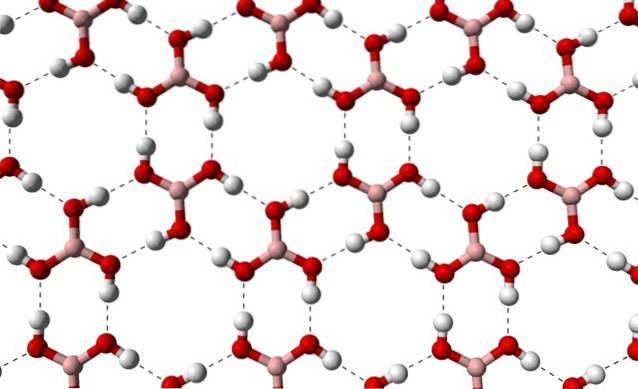
Es ist zu beachten, dass diese Wasserstoffbrücken die gerichteten Wechselwirkungen sind, die Borsäurekristalle steuern und Muster von ornamentalen Aspekten festlegen. Innenringe haben möglicherweise genug Platz, um einige Verunreinigungen zu verschließen, die sich nicht in den Kristalldefekten befinden.
Diese Wasserstoffbrückenbindungen trotz der niedermolekularen Masse von B (OH)3, Sie halten ihr Glas so kohäsiv, dass es eine Temperatur von 171 ° C benötigt, um zu schmelzen. Es ist nicht bekannt, welche Auswirkungen hohe Drücke (in der Größenordnung von GPa) auf die molekularen Schichten von B (OH) haben würden.3.
Eigenschaften
Namen
IUPAC: Borsäure und Bortrihydrooxid. Andere Namen: Orthoborsäure, Borsäure, Sassolit, Borofax und Trihydroxyboran.
Molmasse
61,83 g / mol
Aussehen
Klarer, farbloser, kristalliner weißer Feststoff. Es ist auch als Granulat oder als weißes Pulver erhältlich. Leicht cremig anzufassen.
Geruch
Toilette
Geschmack
Etwas bitter
Schmelzpunkt
170,9 ºC
Siedepunkt
300 ºC
Wasserlöslichkeit
In kaltem Wasser mäßig löslich und in heißem Wasser löslich:
2,52 g / 100 ml (0 ºC)
27,50 g / 100 ml (100 ºC)
Borsäure ist teilweise wasserlöslich und neigt dazu, darin zu sinken. Diese Löslichkeit neigt dazu, in Gegenwart von Säuren wie Salzsäure, Zitronensäure und Weinsäure zuzunehmen..
Löslichkeit in anderen Lösungsmitteln
-Glycerin: 17,5% bei 25 ° C.
-Ethylenglykol: 18,5% bei 25 ° C.
-Aceton: 0,6% bei 25 ° C.
-Ethylacetat: 1,5% bei 25 ° C.
-Methanol: 172 g / l bei 25 ° C.
-Ethanol: 94,4 g / l bei 25 ° C.
Octanol / Wasser-Verteilungskoeffizient
Log P = -0,29
Säure (pKa)
9.24. 12.4. 13.3. Dies sind die drei Konstanten ihrer jeweiligen Dissoziationen zur Freisetzung von H.+ im Wasser.
pH
3,8 - 4,8 (3,3% in wässriger Lösung)
5,1 (0,1 molar)
Dampfdruck
1,6 10-6 mmHg
Stabilität
Stabil im Wasser
Zersetzung
Es zersetzt sich beim Erhitzen auf über 100 ° C unter Bildung von Borsäureanhydrid und Wasser.
Reaktivität
Borsäure bildet mit einwertigen Kationen lösliche Salze, zum Beispiel: NazweiB.4ODER7.10HzweiO und unlösliche Salze mit zweiwertigen Kationen, CaB4ODER7.6HzweiODER.
In wässriger Lösung entsteht eine saure Lösung, wobei angenommen wird, dass diese Eigenschaft auf die Subtraktion von OH-Gruppen zurückzuführen ist- vom Wasser. Borsäure wird als schwache Säure vom Lewis-Typ klassifiziert.
Borsäure reagiert mit Glycerin und Mannit und erhöht den Säuregehalt des wässrigen Mediums. Der pKa wird aufgrund der Bildung des Bor-Mannit-Chelats [BC6H.8ODERzwei(OH)zwei]]-, welches H freigibt+.
Vorbereitung
Borsäure kommt in vulkanischen Emanationen in Regionen wie der Toskana in Italien, den Liparischen Inseln und im US-Bundesstaat Nevada in freiem Zustand vor. Es kommt auch in Mineralien wie Borax, Boracit, Ulexit und Colemanit vor..
Borsäure wird hauptsächlich durch Umsetzung des Minerals Borax (Natriumtetraboratdecahydrat) mit Mineralsäuren wie Salzsäure, Schwefelsäure usw. hergestellt..
N / AzweiB.4ODER910HzweiO + HCl => 4 H.3BO3 + 2 NaCl + 5 H.zweiODER
Es wird auch durch Hydrolyse von Bortrihalogenid und Diboran hergestellt..
Borsäure wird aus Colemanit (Ca.zweiB.6ODERelf6 H.zweiODER). Das Verfahren besteht darin, das Mineral mit Schwefelsäure zu behandeln, um die Borverbindungen aufzulösen.
Dann wird die Lösung, in der Borsäure vorhanden ist, von den ungelösten Fragmenten getrennt. Die Lösung wird mit Schwefelwasserstoff behandelt, um die Arsen- und Eisenverunreinigungen auszufällen. Der Überstand wird abgekühlt, um einen Borsäure-Niederschlag zu erzeugen und ihn von der Suspension abzutrennen..
Anwendungen
In der Industrie
Borsäure wird zur Herstellung von Glasfaser verwendet. Durch die Senkung des Schmelzpunkts wird die Festigkeit und Effizienz von Textilfaserglas erhöht: ein Material zur Verstärkung des in Schiffen, Industrierohren und Computerplatinen verwendeten Kunststoffs..
Borsäure ist an der Herstellung von Borosilikatglas beteiligt, das es ermöglicht, ein Glas zu erhalten, das gegen Temperaturänderungen beständig ist und in der Wohnküche, in Glaswaren in Labors, Leuchtstoffröhren, Glasfasern, LCD-Bildschirmen usw. verwendet werden kann..
Es wird in der metallurgischen Industrie zum Härten und Behandeln von Stahllegierungen sowie zur Förderung der metallischen Beschichtung von Werkstoffen eingesetzt.
Es wird als chemische Komponente beim hydraulischen Fracking (Fracking) verwendet: eine Methode zur Öl- und Gasförderung. Borsäure wirkt feuerhemmend in Zellulose-, Kunststoff- und Textilmaterialien, die mit Borsäure imprägniert sind, um ihre Feuerbeständigkeit zu erhöhen..
In Behandlung
Borsäure wird in Augenspülung verdünnt verwendet. Borsäure-Gelatinekapseln werden zur Behandlung von Pilzinfektionen, insbesondere Candida albicans, verwendet. Es wurde auch bei der Behandlung von Akne verwendet.
Borsäure wird auf Socken gestreut, um Fußinfektionen wie Fußpilz zu vermeiden. Ebenso werden Lösungen, die Borsäure enthalten, bei der Behandlung von äußerer Otitis sowohl beim Menschen als auch bei Tieren verwendet..
Den zur Urinsammlung verwendeten Flaschen wird Borsäure zugesetzt, wodurch eine bakterielle Kontamination verhindert wird, bevor sie in diagnostischen Labors untersucht werden..
Insektizid
Borsäure wird verwendet, um die Verbreitung von Insekten wie Kakerlaken, Termiten, Ameisen usw. zu kontrollieren. Es tötet Kakerlaken nicht sofort ab, da es zuerst das Verdauungs- und Nervensystem beeinträchtigt und zusätzlich das Exoskelett zerstört.
Borsäure übt ihre Wirkung langsam aus, wodurch Insekten, die sie aufgenommen haben, mit anderen Insekten in Kontakt kommen und so eine Vergiftung verbreiten können..
Erhaltung
Borsäure wird verwendet, um den Angriff von Pilzen und Insekten auf Holz zu verhindern, und wird zu diesem Zweck in Verbindung mit Ethylenglykol verwendet. Diese Behandlung ist auch wirksam bei der Bekämpfung von Schlick und Algen..
PH-Puffer
Borsäure und ihre konjugierte Base bilden ein Puffersystem von pKa = 9,24, was darauf hinweist, dass dieser Puffer bei alkalischem pH-Wert am wirksamsten ist, was bei Lebewesen nicht üblich ist. Boratpuffer wird jedoch zur Regulierung des pH-Werts in Schwimmbädern verwendet..
Kernreaktoren
Borsäure hat die Fähigkeit, thermische Neutronen einzufangen, was die Möglichkeit einer unkontrollierten Kernspaltung verringert, die zu nuklearen Unfällen führen kann..
Landwirtschaft
Bor ist ein wesentliches Element für das Pflanzenwachstum, was zur Verwendung von Borsäure als Beitrag des Elements führte. Zu viel Borsäure kann jedoch Pflanzen, insbesondere Zitrusfrüchten, schaden..
Kontraindikationen
Die Verwendung von Borsäure auf entblößten Haut-, Wund- oder Verbrennungsprodukten, die eine Absorption ermöglichen, sollte vermieden werden. Dies ist eine giftige Verbindung im Körper und kann in einigen Fällen Ohnmacht, Krampfanfälle, Krämpfe, Gesichtsschmerzen und niedrigen Blutdruck verursachen..
Der Arzt sollte zur Anwendung von Borsäure-Vaginalkapseln bei schwangeren Frauen konsultiert werden, da darauf hingewiesen wurde, dass dies zu fetalen Deformationen und einer Verringerung des Körpergewichts des Kindes bei der Geburt führen kann..
Die Platzierung von Borsäure, die als Insektizid verwendet wird, an Orten, die für Kinder erreichbar sind, sollte ebenfalls vermieden werden, da Kinder anfälliger für die toxische Wirkung von Borsäure sind und die tödliche Dosis in ihnen bei 2.000 bis 3.000 mg liegt.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Borsäure. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Borsäure. PubChem-Datenbank. CID = 7628. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Die Herausgeber der Encyclopaedia Britannica. (28. März 2019). Borsäure. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- Träger vibriert. (9. November 2018). Die versteckten Verwendungen von Borsäure in Ihrem täglichen Leben. Wiederhergestellt von: Carriervibrating.com
- Nationales Informationszentrum für Pestizide. (s.f.). Borsäure. Wiederhergestellt von: npic.orst.edu
- Abfassung. (30. November 2017). Borsäure: Eigenschaften und Verwendung dieser chemischen Verbindung. Wiederhergestellt von: acidos.info
- Chloridnatrium. (2019). Borsäure. Wiederhergestellt von: chlorurosodio.com
- Spanische Gesellschaft für Krankenhausapotheke. (s.f.). Borsäure. [PDF]. Wiederhergestellt von: workgroups.sefh.es



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.