
Struktur, Eigenschaften, Verwendungen von Kaliumthiocyanat (KSCN)

Das Kaliumthiocyanat Es ist eine anorganische Verbindung, die aus den Elementen Kalium (K), Schwefel (S), Kohlenstoff (C) und Stickstoff (N) besteht. Seine chemische Formel lautet KSCN. Es ist ein farbloser oder weißer Feststoff, der in Wasser sehr gut löslich ist. Es besteht aus einem Kalium-K-Ion+ und ein SCN-Thiocyanation-. KSCN kommt reichlich im Speichel vor.
Kaliumthiocyanat wird als Laborreagenz für verschiedene Arten der chemischen Analyse verwendet. Es wird auch in Tinten und Farben verwendet.

KSCN wurde verwendet, um Dentingelatine (Material unter dem Zahnschmelz) vor dem Auftragen von Zahnreparaturmaterial oder Harz aufzulösen. Es wird auch in der Impfstoffforschung eingesetzt, da es die Extraktion bestimmter biochemischer Elemente aus Bakterien ermöglicht.
Es wird in Form einer Lösung verwendet, bei der sich Metalle während des Polierprozesses durch Elektrizität oder Elektropolieren lösen. Es wurde auch verwendet, um Kunstblut für Filme und Theaterstücke zu erhalten.
Es wird manchmal missbraucht, um die Stabilität der Milch zu erhöhen, wenn sie nicht gekühlt aufbewahrt wird. Es hat jedoch den Nachteil, dass es eine Hypothyreose verursacht, eine Krankheit, bei der die Schilddrüse versagt..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Zersetzungstemperatur
- 3.5 Dichte
- 3.6 Löslichkeit
- 3,7 pH
- 3.8 Andere Eigenschaften
- 4 Erhalten
- 4.1 Präsenz in der Natur
- 5 Verwendungen
- 5.1 In verschiedenen Anwendungen
- 5.2 In zahnärztlichen Anwendungen
- 5.3 In medizinischen Laboratorien
- 5.4 In der Metallindustrie
- 5.5 Am Set von Filmen oder im Theater
- 5.6 Missbrauch von Kaliumthiocyanat
- 6 Risiken
- 7 Referenzen
Struktur
Kaliumthiocyanat besteht aus einem Kalium-K-Kation+ und ein NCS-Thiocyanatanion-. Letzteres wird durch einen Stickstoff (N) gebildet, der über eine Dreifachbindung an einen Kohlenstoff (C) gebunden ist, und einen Schwefel (S), der über eine Einfachbindung an Kohlenstoff gebunden ist.
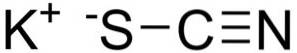
Nomenklatur
- Kaliumthiocyanat
- Kaliumsulfocyanat
- Kaliumsalz der Thiocyansäure
- Kaliumrhodanat
- Kaliumrhodanid
Eigenschaften
Körperlicher Status
Farbloser oder weißer Feststoff.
Molekulargewicht
97,18 g / mol
Schmelzpunkt
173 ºC
Zersetzungstemperatur
500 ºC
Dichte
1,88 g / cm3
Löslichkeit
In Wasser sehr gut löslich: 217 g / 100 ml bei 20 ° C, 238 g / 100 ml bei 25 ° C. Löslich in Ethanol.
pH
Eine 5% ige Lösung von KSCN hat einen pH zwischen 5,3 und 8,7.
Andere Eigenschaften
Reine, trockene Kaliumthiocyanatproben sind unbegrenzt stabil, wenn sie in dicht verschlossenen Gläsern im Dunkeln aufbewahrt werden. Bei Kontakt mit direktem Sonnenlicht werden die farblosen Kristalle jedoch schnell gelblich..
Lösungen von reinem KSCN-Salz, die vor Licht geschützt sind, sind vollständig stabil.
KSCN kann Gelatine und Kollagen quellen. Wässrige Lösungen von Kaliumthiocyanat bei der Reaktion mit Mangandioxid MnOzwei oxidieren und bilden Thiocyanogen (SCN)zwei.
Erhalten
Kaliumthiocyanat kann durch Schmelzen von Kaliumcyanid (KCN) mit Schwefel (S) hergestellt werden. Die Reaktion ist schnell und quantitativ.
KCN + S → KSCN
Es kann in Lösung erhalten werden, indem Schwefel (S) in Benzol oder Aceton gelöst und eine Lösung von Kaliumcyanid (KCN) in Isopropanol zugegeben wird. Diese Reaktion wird verwendet, um die Schwefelmenge in einer Lösung zu analysieren.
Kaliumthiocyanat kann durch aufeinanderfolgende Umkristallisationen aus Wasser oder Ethanol rein erhalten werden..
Präsenz in der Natur
Kaliumthiocyanat kommt reichlich im Speichel vor (15 mg / dl), fehlt aber im Blut.
Auch die Milch einiger Säugetiere (wie Kühe) enthält auf natürliche Weise sehr geringe Mengen an Thiocyanat.
Anwendungen
In verschiedenen Anwendungen
Kaliumthiocyanat wurde in verschiedenen chemischen Analysen verwendet. Es wurde zur Analyse oder Titration von Silberionen verwendet, auch als Reagenz und Indikator für andere Analysen.
KSCN wird in Farbstoffen und Pigmenten verwendet. Wird in Farben und Tinten verwendet.
In der Fotoindustrie wird es insbesondere bei der Herstellung von Fotofilmen eingesetzt, da es die feste Abscheidung von Gelatine aus Kunststofffolien ermöglicht..
Die Konzentration von Thiocyanat im Blut wurde in medizinisch-wissenschaftlichen Experimenten verwendet, um den Grad des Rauchens einiger Menschen zu bestimmen, da Thiocyanat ein Produkt ist, das aus Cyanwasserstoff (HCN) im Tabakrauch gewonnen wird..
In zahnärztlichen Anwendungen
Kaliumthiocyanat wurde zur Reparatur von Tierzähnen verwendet. Es wurde erfolgreich als Vorbehandlung auf die Dentinoberfläche aufgetragen, bevor das Mittel zum Füllen oder Verstopfen des offenen Lochs aufgetragen wurde.
Dentin ist die Schicht, die sich unter dem Zahnschmelz befindet.
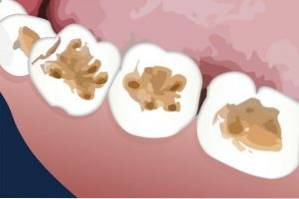
Kaliumthiocyanat begünstigt das Quellen der Gelatine auf dem Dentin, so dass diese Schicht leicht entfernt werden kann und eine bessere Haftung oder Bindung des Materials, das den Zahn (Harz) versiegelt, resultiert..
In medizinischen Labors
KSCN wird zur Herstellung von Impfstoffen oder Bakterienextrakten verwendet.
Die pathogenen Bakterien werden durch Inkubation in geeigneten Laborbehältern gezüchtet. Dann werden ein Phosphat-pH-Regler und KSCN in den Behälter gegeben, in dem sich die Bakterienkultur befindet..
Ein Teil dieses Bakterienpräparats wird entnommen und in ein Glas gegeben. Es wird für eine geeignete Zeit gerührt und die Suspension wird zentrifugiert, um die Flüssigkeit vom festen Material zu trennen. Der Überstand (Flüssigkeit) wird gesammelt und dialysiert.
Das Ergebnis ist ein Extrakt, der zur Impfung in wissenschaftlichen Experimenten mit Labortieren verwendet wird..
In der Metallindustrie
Kaliumthiocyanat wird beim Elektropolieren von Metallen verwendet. Elektropolieren ist ein chemischer Prozess, bei dem die Oberfläche eines Metalls behandelt werden kann, um seine Mikrorauheit zu verringern, dh um die Metalloberfläche zu glätten.
Dies geschieht mit Elektrizität, wodurch das zu glättende Metall als positiver Pol oder Anode der Elektrolysezelle fungiert. Die Rauheit löst sich in der Kaliumthiocyanatlösung und das Metall ist somit glatter.
Am Set von Filmen oder im Theater
Das KSCN wird zur Simulation von Blut in Film- und Fernsehfilmen oder in Theaterstücken verwendet.
Zum Beispiel wird eine Lösung von Kaliumthiocyanat (KSCN) auf den Bereich des Körpers aufgetragen, der den Schnitt oder den simulierten Angriff "erleidet". Das Plastikmesser oder das simulierte Schneidobjekt wird in eine Lösung von Eisenchlorid (FeCl) getaucht3).
Das „scharfe“ Objekt mit FeCl wird vorsichtig passiert3 auf in KSCN angefeuchteter Haut. Sofort bildet sich ein roter Streifen oder Fleck, der dem von Blut sehr ähnlich ist.
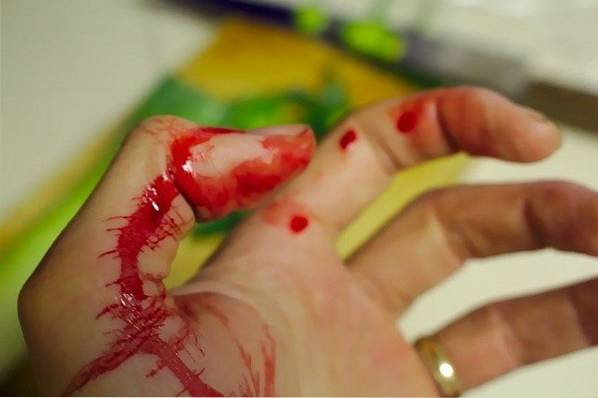
Dies ist auf die Bildung eines Komplexes aus Eisen (III) -thiocyanat und Wasser zurückzuführen [Fe (NCS) (H.zweiODER)5]]zwei+ Das hat eine intensive rote Farbe, die dem Blut sehr ähnlich ist:
KSCN + FeCl3 + 5 hzweiO → [Fe (NCS) (H.zweiODER)5]]zwei+ + 2 Cl- + KCl

Missbrauch von Kaliumthiocyanat
Kaliumthiocyanat wird skrupellos verwendet, um zu verhindern, dass Milch von Bakterien oder Pilzen befallen wird, ihre Eigenschaften verliert und sich verschlechtert.
In tropischen Ländern wird eine Methode namens "Lacto-Peroxidase-System" oder LP-System verwendet, die die Stabilität der Milch erhöht, wenn sie bei hohen Umgebungstemperaturen gelagert wird, wenn keine Kühlung möglich ist..

Diese Methode verwendet das natürliche antibakterielle System der Milch, das durch Erhöhen der Konzentration von Thiocyanat (in Milch bereits in geringen Mengen vorhanden) und Wasserstoffperoxid (H) aktiviert wirdzweiODERzwei).
Diese Methode ist jedoch in vielen Ländern von den Behörden, die verarbeitete Lebensmittel regeln, nicht zulässig..
Einige skrupellose Menschen fügen KSCN hinzu, um irrational mit oder ohne H zu melkenzweiODERzwei, Dies stellt eine Gefahr für die Gesundheit des Verbrauchers dar, da Thiocyanate Substanzen sind, die die Schilddrüse schädigen und bei Einnahme in hohen Konzentrationen eine Hypothyreose verursachen können.

Risiken
Das Einatmen von Kaliumthiocyanatpulver sollte vermieden werden. Es ist ratsam, beim Umgang mit Handschuhen und Schutzbrillen Handschuhe zu tragen. Nach kurzer Einwirkung von Kaliumthiocyanat kann es Auswirkungen auf das Nervensystem haben, wie übermäßige Emotionen ohne Motiv, Unruhe und Krampfanfälle..
Nach einer langen Exposition können die Schilddrüse und das Zentralnervensystem betroffen sein, was sich in einer Hypothyreose bzw. einer Verschlechterung einiger Funktionen äußert. Bei Verschlucken kann es zu Verwirrung, Übelkeit, Erbrechen, Krampfanfällen und Schwäche kommen..
Durch Zünden oder Verbrennen des KSCN werden hochgiftige Cyanidgase freigesetzt. Dies geschieht auch beim Hinzufügen von Säuren. Im Labor sollte es in einem gut belüfteten Abzug gehandhabt werden..
Verweise
- Jarvinen, L.Z. et al. (1998). Induktion der Schutzimmunität bei Kaninchen durch gleichzeitige Verabreichung von Inaktivierten Pasteurella multocida Toxin- und Kaliumthiocyanatextrakt. Infektion und Immunität, Aug. 1998, p. 3788-3795. Von ncbi.nlm.nih.gov wiederhergestellt.
- Tani, Y. und Togaya, T. (1995). Dentinoberflächenbehandlung ohne Säuren. Dental Materials Journal 14 (1): 58-69, 1995. Abgerufen von jstage.jst.go.jp.
- Kolthoff, I.M. und Lingane, J.J. (1935). Kaliumthiocyanat als primäre Standardsubstanz. Journal of the American Chemical Society 1935, 57, 11, 2126-2131. Von pubs.acs.org wiederhergestellt.
- Balmasov, A.V. et al. (2005). Elektropolieren von Silber in wasserorganischen Lösungen von Kaliumthiocyanat. Prot Met 41, 354 & ndash; 357 (2005). Von link.springer.com wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Lide, D.R. (Herausgeber) (2003). CRC Handbuch für Chemie und Physik. 85th CRC Drücken Sie.
- Tyner, T. und Francis, J. (2017). Kaliumthiocyanat. ACS-Reagenzienchemikalien. Von pubs.acs.org wiederhergestellt.
- Kanthale, P. et al. (2015). Qualitativer Test zum Nachweis von fremdem Thiocyanat in Milch. J Food Sci Technol (März 2015) 52 (3): 1698 & ndash; 1704. Von ncbi.nlm.nih.gov wiederhergestellt.
- Roy, D. et al. (2018) Fluoreszenzsonde auf der Basis von Siliziumquantenpunkten: Charakterisierung der Synthese und Erkennung von Thiocyanat im menschlichen Blut. ACS Omega 2018, 3, 7, 7613-7620. Von pubs.acs.org wiederhergestellt.
- Gammon, K. (2018). Die Wissenschaft vom Kunstblut. Inside Science. Von insidescience.org wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.