
Ursachen, Beispiele, Anwendungen und Experimente der Oberflächenspannung
Das Oberflächenspannung Es ist eine physikalische Eigenschaft, dass alle Flüssigkeiten vorhanden sind, und sie ist durch den Widerstand gekennzeichnet, den ihre Oberflächen gegen eine Vergrößerung ihrer Fläche haben. Dies ist das Gleiche wie zu sagen, dass die Oberfläche nach der kleinstmöglichen Fläche sucht. Dieses Phänomen verflochten verschiedene chemische Konzepte wie Kohäsion, Adhäsion und intermolekulare Kräfte..
Die Oberflächenspannung ist für die Bildung von Oberflächenkrümmungen von Flüssigkeiten in Rohrbehältern (Messzylinder, Säulen, Reagenzgläser usw.) verantwortlich. Diese können konkav (in Form eines Tals gekrümmt) oder konvex (in Form einer Kuppel gekrümmt) sein. Viele physikalische Phänomene lassen sich unter Berücksichtigung der Veränderungen erklären, die die Oberflächenspannung einer Flüssigkeit erfährt..

Eines dieser Phänomene ist die Tendenz flüssiger Moleküle, in Form von Tropfen zu agglomerieren, wenn sie auf Oberflächen ruhen, die sie abstoßen. Zum Beispiel können die Wassertropfen, die wir oben auf den Blättern sehen, sie aufgrund ihrer wachsartigen, hydrophoben Oberfläche nicht benetzen..
Es kommt jedoch eine Zeit, in der die Schwerkraft ihre Rolle spielt und der Tropfen wie eine Wassersäule herausläuft. Ein ähnliches Phänomen tritt bei kugelförmigen Quecksilbertropfen auf, wenn sie von einem Thermometer verschüttet werden.
Andererseits ist die Oberflächenspannung von Wasser die wichtigste von allen, da sie zum Zustand mikroskopischer Körper in wässrigen Medien wie Zellen und ihren Lipidmembranen beiträgt und diesen organisiert. Darüber hinaus ist diese Spannung dafür verantwortlich, dass das Wasser langsam verdunstet und einige Körper dichter sind, als es auf seiner Oberfläche schwimmen kann..
Artikelverzeichnis
- 1 Ursachen der Oberflächenspannung
- 2 Einheiten
- 3 Oberflächenspannung von Wasser
- 4 Andere Beispiele
- 4.1 Kondensierte Gase
- 4.2 Unpolare Flüssigkeiten
- 4.3 Polare Flüssigkeiten
- 5 Anwendungen
- 5.1 Reinigungsmittel
- 5.2 Emulsionen
- 6 einfache Experimente
- 6.1 Clip-Experiment
- 6.2 Papierschiff
- 7 Referenzen
Ursachen der Oberflächenspannung
Die Erklärung für das Phänomen der Oberflächenspannung liegt auf molekularer Ebene. Die Moleküle einer Flüssigkeit interagieren so miteinander, dass sie in ihren unregelmäßigen Bewegungen zusammenhalten. Ein Molekül interagiert mit seinen Nachbarn daneben und mit denen darüber oder darunter.
Dies ist jedoch nicht dasselbe bei den Molekülen auf der Oberfläche der Flüssigkeit, die mit Luft (oder einem anderen Gas) oder einem Feststoff in Kontakt stehen. Moleküle auf der Oberfläche können nicht mit denen der äußeren Umgebung kohäsieren.
Infolgedessen erfahren sie keine Kräfte, die sie nach oben ziehen. nur nach unten, von seinen Nachbarn im flüssigen Medium. Um diesem Ungleichgewicht entgegenzuwirken, "quetschen" sich die Oberflächenmoleküle, denn nur so können sie die Kraft überwinden, die sie nach unten drückt.
Dann entsteht eine Oberfläche, auf der sich die Moleküle angespannter befinden. Wenn ein Partikel in die Flüssigkeit eindringen möchte, muss es zuerst diese molekulare Barriere proportional zur Oberflächenspannung der Flüssigkeit überschreiten. Gleiches gilt für ein Partikel, das aus den Tiefen der Flüssigkeit in die äußere Umgebung entweichen möchte..
Daher verhält sich seine Oberfläche so, als wäre es ein elastischer Film, der Beständigkeit gegen Verformung zeigt..
Einheiten
Die Oberflächenspannung wird normalerweise durch das Symbol γ dargestellt und in Einheiten N / m, Kraft mal Länge ausgedrückt. Meistens ist seine Einheit jedoch der Dyn / cm. Einer kann durch den folgenden Umrechnungsfaktor in den anderen umgewandelt werden:
1 dyn / cm = 0,001 N / m
Oberflächenspannung von Wasser
Wasser ist die seltenste und erstaunlichste aller Flüssigkeiten. Seine Oberflächenspannung sowie einige seiner Eigenschaften sind ungewöhnlich hoch: 72 dyn / cm bei Raumtemperatur. Dieser Wert kann bei einer Temperatur von 0 ºC auf 75,64 dyn / cm ansteigen; oder auf 58,85 ºC bei einer Temperatur von 100 ºC abnehmen.
Diese Beobachtungen sind sinnvoll, wenn man bedenkt, dass sich die molekulare Barriere bei Temperaturen nahe dem Gefrierpunkt noch stärker verschärft oder sich um den Siedepunkt herum etwas mehr "lockert"..
Wasser hat aufgrund seiner Wasserstoffbrücken eine hohe Oberflächenspannung. Wenn diese an sich in der Flüssigkeit wahrnehmbar sind, sind sie an der Oberfläche umso mehr. Wassermoleküle sind stark verwickelt und bilden Dipol-Dipol-Wechselwirkungen vom H-Typ.zweiOH OH.

Die Effizienz ihrer Wechselwirkungen ist so hoch, dass die wässrige molekulare Barriere sogar einige Körper unterstützen kann, bevor sie sinken. In den Abschnitten zu Anwendungen und Experimenten wird dieser Punkt wiederholt.
Andere Beispiele
Alle Flüssigkeiten weisen Oberflächenspannungen auf, entweder in geringerem oder größerem Maße als Wasser oder ob es sich um reine Substanzen oder Lösungen handelt. Wie stark und angespannt die molekularen Barrieren seiner Oberflächen sind, hängt direkt von ihren intermolekularen Wechselwirkungen sowie von strukturellen und energetischen Faktoren ab..
Kondensierte Gase
Beispielsweise interagieren Gasmoleküle im flüssigen Zustand nur durch Londoner Dispersionskräfte miteinander. Dies steht im Einklang mit der Tatsache, dass ihre Oberflächenspannungen niedrige Werte haben:
-Flüssiges Helium, 0,37 dyn / cm bei -273 ºC
-Flüssiger Stickstoff, 8,85 dyn / cm bei -196 ºC
-Flüssiger Sauerstoff, 13,2 dyn / cm bei -182 ºC
Die Oberflächenspannung von flüssigem Sauerstoff ist höher als die von Helium, da seine Moleküle eine größere Masse haben..
Unpolare Flüssigkeiten
Es wird erwartet, dass unpolare und organische Flüssigkeiten höhere Oberflächenspannungen aufweisen als diese kondensierten Gase. Unter einigen von ihnen haben wir Folgendes:
-Diethylether, 17 dyn / cm bei 20 ° C.
-n-Hexan, 18,40 dyn / cm bei 20 ° C.
-n-Oktan, 21,80 dyn / cm bei 20 ° C.
-Toluol, 27,73 dyn / cm bei 25 ºC
Ein ähnlicher Trend ist bei diesen Flüssigkeiten zu beobachten: Die Oberflächenspannung nimmt mit zunehmender Molmasse zu. Die n-Octan sollte demnach die höchste Oberflächenspannung und nicht Toluol haben. Hier kommen molekulare Strukturen und Geometrien ins Spiel.
Toluolmoleküle, flach und ringförmig, haben effektivere Wechselwirkungen als die von n-Oktan. Daher ist die Oberfläche von Toluol "dichter" als die Oberfläche von n-Oktan.
Polare Flüssigkeiten
Da es stärkere Dipol-Dipol-Wechselwirkungen zwischen den Molekülen einer polaren Flüssigkeit gibt, neigen sie dazu, höhere Oberflächenspannungen zu zeigen. Dies ist jedoch nicht immer der Fall. Unter einigen Beispielen haben wir:
-Essigsäure, 27,60 dyn / cm bei 20 ° C.
-Aceton, 23,70 dyn / cm bei 20 ° C.
-Blut, 55,89 dyn / cm bei 22 ° C.
-Ethanol, 22,27 dyn / cm bei 20 ° C.
-Glycerin, 63 dyn / cm bei 20 ° C.
-Geschmolzenes Natriumchlorid, 163 dyn / cm bei 650 ° C.
-6 M NaCl-Lösung, 82,55 dyn / cm bei 20 ° C.
Es wird erwartet, dass geschmolzenes Natriumchlorid eine enorme Oberflächenspannung aufweist: Es ist eine viskose, ionische Flüssigkeit..
Andererseits ist Quecksilber eine der Flüssigkeiten mit der höchsten Oberflächenspannung: 487 dyn / cm. Darin besteht seine Oberfläche aus stark kohäsiven Quecksilberatomen, viel mehr als Wassermoleküle sein können..
Anwendungen

Oberflächenspannung allein hat keine Anwendung. Dies bedeutet jedoch nicht, dass es nicht an verschiedenen täglichen Phänomenen beteiligt ist, die, wenn sie nicht existieren würden, nicht auftreten würden..
Zum Beispiel können Mücken und andere Insekten durch Wasser laufen. Dies liegt daran, dass ihre hydrophoben Beine Wasser abweisen, während ihre geringe Masse es ihnen ermöglicht, auf der molekularen Barriere über Wasser zu bleiben, ohne auf den Grund des Flusses, des Sees, des Teichs usw. zu fallen..
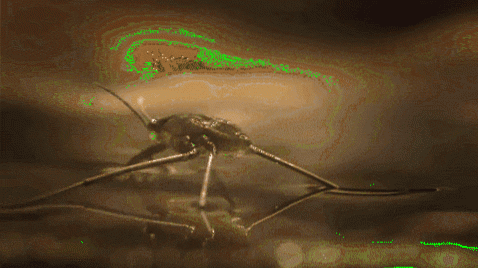
Die Oberflächenspannung spielt auch eine Rolle bei der Benetzbarkeit von Flüssigkeiten. Je höher die Oberflächenspannung ist, desto geringer ist die Tendenz, durch Poren oder Risse in einem Material zu sickern. Darüber hinaus sind sie keine sehr nützlichen Flüssigkeiten zum Reinigen von Oberflächen.
Reinigungsmittel
Hier wirken Waschmittel, die die Oberflächenspannung des Wassers verringern und ihm helfen, größere Oberflächen zu bedecken. während die Entfettungswirkung verbessert wird. Durch die Verringerung der Oberflächenspannung schafft es Platz für Luftmoleküle, mit denen es Blasen bildet..
Emulsionen
Andererseits sind niedrige höhere Spannungen mit der Stabilisierung der Emulsionen verbunden, die für die Formulierung einer anderen Produktreihe sehr wichtig sind..
Einfache Experimente

Abschließend werden einige Experimente angeführt, die in jedem häuslichen Raum durchgeführt werden können..
Clip-Experiment
Ein Metallclip wird auf seine Oberfläche in ein Glas kaltes Wasser gelegt. Wie im Bild oben zu sehen, bleibt der Clip dank der Oberflächenspannung des Wassers über Wasser. Wenn Sie dem Glas jedoch etwas Lava aus Steingut hinzufügen, sinkt die Oberflächenspannung dramatisch und die Büroklammer hängt plötzlich durch..
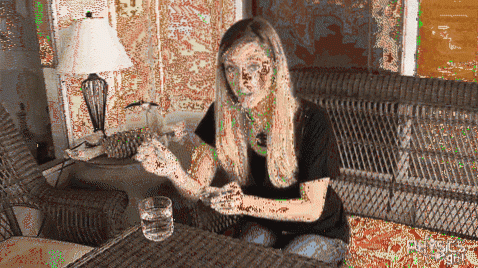
Papierschiffchen
Wenn wir an der Oberfläche ein Papierboot oder eine Holzpalette haben und der Geschirrspüler oder das Waschmittel dem Kopf eines Tupfers hinzugefügt wird, tritt ein interessantes Phänomen auf: Es wird eine Abstoßung geben, die sie zu den Rändern des Tupfers ausbreitet Glas. Das Papierschiff und die Holzpalette entfernen sich von dem mit Reinigungsmittel verschmierten Tupfer.

Ein anderes ähnliches und anschaulicheres Experiment besteht darin, den gleichen Vorgang zu wiederholen, jedoch in einem mit schwarzem Pfeffer bestreuten Eimer Wasser. Die schwarzen Pfefferpartikel driften weg und die Oberfläche ändert sich von bedecktem Pfeffer zu kristallklarem Pfeffer mit dem Pfeffer an den Rändern.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Wikipedia. (2020). Oberflächenspannung. Wiederhergestellt von: en.wikipedia.org
- USGS. (s.f.). Oberflächenspannung und Wasser. Wiederhergestellt von: usgs.gov
- Jones, Andrew Zimmerman. (12. Februar 2020). Oberflächenspannung - Definition und Experimente. Wiederhergestellt von :oughtco.com
- Susanna Laurén. (2017, 15. November). Warum ist Oberflächenspannung wichtig? Biolin Scientific. Wiederhergestellt von: blog.biolinscientific.com
- Rookie Parenting Science. (07. November 2019). Was ist Oberflächenspannung? Cooles wissenschaftliches Experiment. Wiederhergestellt von: rookieparenting.com
- Jessica Munk. (2020). Oberflächenspannungsexperimente. Studie. Wiederhergestellt von: study.com
- Das Kind sollte das sehen. (2020). Sieben Oberflächenspannungsexperimente - Physics Girl. Wiederhergestellt von: thekidshouldseethis.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.