
Struktur, Eigenschaften, Synthese und Verwendung von Cyclohexen
Das Cyclohexen ist ein cyclisches Alken oder Olefin, dessen Summenformel C ist6H.10. Es besteht aus einer farblosen Flüssigkeit, die in Wasser unlöslich und mit vielen organischen Lösungsmitteln mischbar ist. Es zeichnet sich dadurch aus, dass es brennbar ist, und in der Natur kommt es normalerweise in Kohlenteer vor.
Cyclohexen wird durch partielle Hydrierung von Benzol und durch Dehydratisierung des Alkohols Cyclohexanol synthetisiert; das heißt, eine stärker oxidierte Form. Wie andere Cycloalkene unterliegt es elektrophilen und radikalischen Additionsreaktionen; zum Beispiel die Halogenierungsreaktion.

Dieses cyclische Alken (oberes Bild) bildet mit niederen Alkoholen und Essigsäure azeotrope Gemische (nicht durch Destillation trennbar). Es ist bei längerer Lagerung nicht sehr stabil, da es sich unter Einwirkung von Sonnenlicht und ultravioletter Strahlung zersetzt.
Cyclohexen wird als Lösungsmittel verwendet und hat daher zahlreiche Anwendungen, wie zum Beispiel: Stabilisator von Benzin mit hoher Oktanzahl und zur Extraktion von Ölen.
Das Wichtigste ist jedoch, dass Cyclohexen als Zwischen- und Rohstoff für die Gewinnung zahlreicher hoch nützlicher Verbindungen dient, darunter: Cyclohexanon, Adipinsäure, Maleinsäure, Cyclohexan, Butadien, Cyclohexylcarbonsäure usw..
Artikelverzeichnis
- 1 Struktur von Cyclohexen
- 1.1 Intermolekulare Wechselwirkungen
- 2 Eigenschaften
- 2.1 Chemische Namen
- 2.2 Molekulargewicht
- 2.3 Aussehen
- 2.4 Geruch
- 2,5 Siedepunkt
- 2.6 Schmelzpunkt
- 2.7 Flammpunkt
- 2.8 Löslichkeit in Wasser
- 2.9 Löslichkeit in organischen Lösungsmitteln
- 2.10 Dichte
- 2.11 Dampfdichte
- 2.12 Dampfdruck
- 2.13 Selbstentzündung
- 2.14 Zersetzung
- 2.15 Viskosität
- 2.16 Verbrennungswärme
- 2.17 Verdampfungswärme
- 2.18 Oberflächenspannung
- 2.19 Polymerisation
- 2.20 Geruchsschwelle
- 2.21 Brechungsindex
- 2,22 pH
- 2.23 Stabilität
- 2.24 Reaktionen
- 3 Synthese
- 4 Verwendungen
- 5 Risiken
- 6 Referenzen
Struktur von Cyclohexen
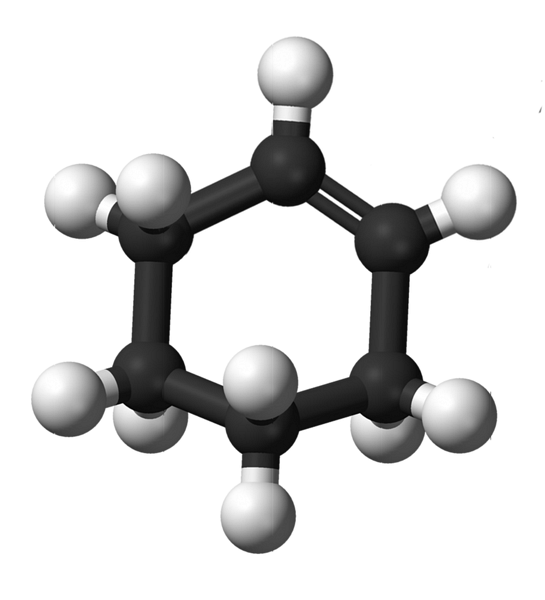
Das obere Bild zeigt die Struktur von Cyclohexen mit einem Modell von Kugeln und Balken. Beachten Sie den Sechs-Kohlenstoff-Ring und die Doppelbindung, beide Ungesättigtheiten der Verbindung. Aus dieser Perspektive scheint der Ring flach zu sein; aber es ist überhaupt nicht.
Zunächst weisen die Kohlenstoffe der Doppelbindung eine sp-Hybridisierung aufzwei, was ihnen eine trigonale Ebenengeometrie gibt. Daher befinden sich diese beiden Kohlenstoffe und die ihnen benachbarten in derselben Ebene; während sich die beiden Kohlenstoffe am gegenüberliegenden Ende (zur Doppelbindung) oberhalb und unterhalb der Ebene befinden.
Das Bild unten zeigt perfekt, was gerade erklärt wurde.

Beachten Sie, dass das schwarze Band aus vier Kohlenstoffen besteht: den beiden der Doppelbindung und den anderen angrenzenden. Die belichtete Perspektive ist diejenige, die erhalten würde, wenn ein Zuschauer sein Auge direkt vor die Doppelbindung stellen würde. Es ist dann zu sehen, dass sich ein Kohlenstoff über und unter dieser Ebene befindet.
Da das Cyclohexenmolekül nicht statisch ist, tauschen sich die beiden Kohlenstoffe aus: einer sinkt ab, während der andere über die Ebene steigt. Sie würden also erwarten, dass sich dieses Molekül verhält.
Intermolekulare Wechselwirkungen
Cyclohexen ist ein Kohlenwasserstoff, und daher basieren seine intermolekularen Wechselwirkungen auf den Londoner Dispersionskräften.
Dies liegt daran, dass das Molekül unpolar ist und kein permanentes Dipolmoment aufweist. Sein Molekulargewicht ist der Faktor, der am meisten dazu beiträgt, dass es in der Flüssigkeit kohäsiv bleibt..
Ebenso erhöht die Doppelbindung den Wechselwirkungsgrad, da sie sich nicht mit der gleichen Flexibilität wie die anderen Kohlenstoffe bewegen kann, was die Wechselwirkung zwischen benachbarten Molekülen begünstigt. Aus diesem Grund hat Cyclohexen einen etwas höheren Siedepunkt (83 ° C) als Cyclohexan (81 ° C)..
Eigenschaften
Chemische Namen
Cyclohexen, Tetrahydrobenzol.
Molekulargewicht
82,146 g / mol.
Aussehen
Farblose Flüssigkeit.
Geruch
Süßer Geruch.
Siedepunkt
83 ºC bei 760 mmHg.
Schmelzpunkt
-103,5 ºC.
Zündpunkt
-7 ºC (geschlossene Tasse).
Wasserlöslichkeit
Praktisch unlöslich (213 mg / l).
Löslichkeit in organischen Lösungsmitteln
Mit Ethanol, Benzol, Tetrachlorkohlenstoff, Petrolether und Aceton mischbar. Es wird erwartet, dass es in der Lage ist, unpolare Verbindungen wie einige der Allotrope von Kohlenstoff aufzulösen..
Dichte
0,810 g / cm3 bei 20ºC.
Wasserdampfdichte
2,8 (bezogen auf Luft gleich 1).
Dampfdruck
89 mmHg bei 25ºC.
Selbstentzündung
244 ºC.
Zersetzung
Es zersetzt sich in Gegenwart von Uransalzen unter Einwirkung von Sonnenlicht und ultravioletter Strahlung.
Viskosität
0,625 mPascal bei 25 ºC.
Verbrennungswärme
3.751,7 kJ / mol bei 25 ºC.
Verdampfungswärme
30,46 kJ / mol bei 25 ° C..
Oberflächenspannung
26,26 mN / m.
Polymerisation
Kann unter bestimmten Bedingungen polymerisieren.
Geruchsschwelle
0,6 mg / m3.
Brechungsindex
1,4465 bei 20 ºC.
pH
7-8 bis 20ºC.
Stabilität
Cyclohexen ist während der Langzeitlagerung nicht sehr stabil. Licht und Luft können zur Bildung von Peroxiden führen. Es ist auch nicht kompatibel mit starken Oxidationsmitteln..
Reaktionen
-Cycloalkene gehen hauptsächlich Additionsreaktionen ein, sowohl elektrophil als auch mit freien Radikalen.
-Reagiert mit Brom unter Bildung von 1,2-Dibromcyclohexan.
-Es oxidiert schnell in Gegenwart von Kaliumpermanganat (KMnO)4).
-Es ist in der Lage, in Gegenwart von Peroxybenzoesäure ein Epoxid (Cyclohexenoxid) zu erzeugen.
Synthese
Cyclohexen wird durch Säurekatalyse von Cyclohexanol hergestellt:
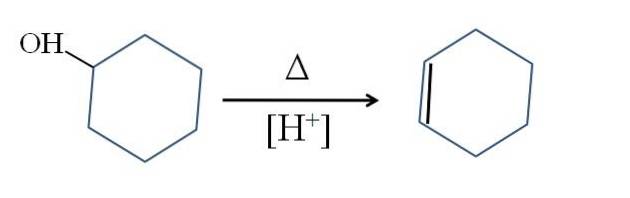
Das Symbol Δ steht für die Wärme, die erforderlich ist, um den Austritt der OH-Gruppe als Wassermolekül in einem sauren Medium (-OH) zu fördernzwei+).
Cyclohexen wird auch durch partielle Hydrierung von Benzol hergestellt; Das heißt, zwei seiner Doppelbindungen fügen ein Wasserstoffmolekül hinzu:
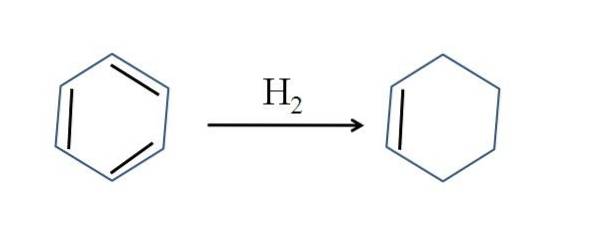
Obwohl die Reaktion einfach zu sein scheint, erfordert sie große Drücke von H.zwei und Katalysatoren.
Anwendungen
-Es ist als organisches Lösungsmittel nützlich. Darüber hinaus ist es ein Rohstoff für die Herstellung von Adipinsäure, Adipaldehyd, Maleinsäure, Cyclohexan und Cyclohexylcarbonsäure..
-Es wird zur Herstellung von Cyclohexanchlorid verwendet, einer Verbindung, die als Zwischenprodukt bei der Herstellung von pharmazeutischen Produkten und Kautschukadditiven verwendet wird.
-Cyclohexen wird auch zur Synthese von Cyclohexanon verwendet, einem Rohstoff für die Herstellung von Arzneimitteln, Pestiziden, Parfums und Farbstoffen..
-Cyclohexen ist an der Synthese von Aminocyclohexanol beteiligt, einer Verbindung, die als Tensid und Emulgator verwendet wird.
-Darüber hinaus kann Cyclohexen zur Laborherstellung von Butadien verwendet werden. Die letztere Verbindung wird bei der Herstellung von synthetischem Kautschuk, bei der Herstellung von Autoreifen und auch bei der Herstellung von Acrylkunststoffen verwendet..
-Cyclohexen ist ein Rohstoff für die Synthese von Lysin, Phenol, Polycycloolefinharz und Kautschukadditiven.
-Es wird als Stabilisator für Benzin mit hoher Oktanzahl verwendet.
-Eingriffe in die Synthese von wasserfesten Beschichtungen, rissbeständigen Folien und Bindemitteln für Beschichtungen.
Risiken
Cyclohexen ist keine sehr giftige Verbindung, kann jedoch bei Kontakt zu Rötungen der Haut und der Augen führen. Einatmen kann Husten und Schläfrigkeit verursachen. Darüber hinaus kann seine Einnahme Schläfrigkeit, Atemnot und Übelkeit verursachen..
Cyclohexen wird vom Magen-Darm-Trakt schlecht resorbiert, daher sind bei Einnahme keine schwerwiegenden systemischen Auswirkungen zu erwarten. Die maximale Komplikation ist das Absaugen durch die Atemwege, was zu einer chemischen Lungenentzündung führen kann.
Verweise
- Joseph F. Chiang und Simon Harvey Bauer. (1968). Molekülstruktur von Cyclohexen. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyclohexen: Gefahren, Synthese und Struktur. Studie. Wiederhergestellt von: study.com
- Morrison, R. T. und Boyd, R. N. (1987). Organische Chemie. (5ta Auflage.). Editorial Addison-Wesley Iberoamericana.
- PubChem. (2019). Cyclohexen. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Chemisches Buch. (2019). Cyclohexen. Wiederhergestellt von: Chemicalbook.com
- Toxikologisches Datennetz. (2017). Cyclohexen. Toxnet. Wiederhergestellt von: toxnet.nlm.nih.gov
- Chemoxy. (s.f.). Die Strukturformel für Cyclohexen lautet. Wiederhergestellt von: chemoxy.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.