
Cycloalkaneigenschaften, Reaktionen, Verwendungen, Beispiele

Das Cycloalkane sind eine Familie von gesättigten Kohlenwasserstoffen mit einer allgemeinen Formel von C.nH.2n das stimmt mit dem der Alkene überein; mit dem Unterschied, dass die scheinbare Ungesättigtheit nicht auf eine Doppelbindung zurückzuführen ist, sondern auf einen Ring oder Zyklus. Deshalb gelten sie als Isomere von Alkenen.
Diese entstehen, wenn lineare Alkane die Enden ihrer Ketten verbinden, um eine geschlossene Struktur zu erzeugen. Wie bei Alkanen können Cycloalkane unterschiedliche Größen, Molekularmassen, Substitutionen oder sogar Systeme aufweisen, die aus mehr als einem Ring bestehen (polycyclisch)..
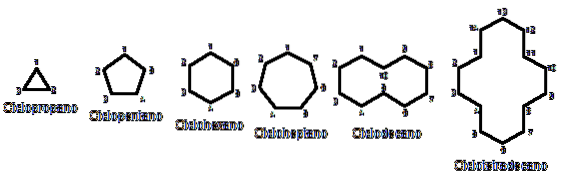
Ansonsten sind sie chemisch und physikalisch Alkanen ähnlich. Sie haben nur Kohlenstoffe und Wasserstoffatome, sind neutrale Moleküle und interagieren daher durch Van-der-Walls-Kräfte. Sie dienen auch als Brennstoffe und geben Wärme ab, wenn sie in Gegenwart von Sauerstoff verbrennen..
Warum sind Cycloalkane instabiler als ihre offenkettigen Gegenstücke? Der Grund kann vermutet werden, wenn man die im obigen Bild dargestellten Beispiele für Cycloalkane aus der Vogelperspektive betrachtet: Es gibt sterische (räumliche) Spannungen und Hindernisse.
Beachten Sie, dass die Struktur umso geschlossener ist, je weniger Kohlenstoffe vorhanden sind (blau aufgeführt). und das Gegenteil tritt ein, wenn sie zunehmen und wie eine Halskette werden.
Kleine Cycloalkane sind gasförmig und mit zunehmender Größe auch ihre intermolekularen Kräfte. Folglich können sie Flüssigkeiten sein, die Fette und unpolare Moleküle, Schmiermittel oder Feststoffe lösen können, die dunkle Farben und Eigenschaften wie die von Asphalt aufweisen..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 1.1 Polarität
- 1.2 Intermolekulare Wechselwirkungen
- 1.3 Sättigung
- 1.4 Stabilität
- 2 Nomenklatur
- 3 Struktur
- 3.1 Konformationen
- 4 Reaktionen
- 5 Verwendungen
- 6 Beispiele für Cycloalkane
- 7 Referenzen
Physikalische und chemische Eigenschaften
Polarität
Da sie nur aus Kohlenstoffen und Wasserstoffatomen bestehen, Atomen, die sich an sich in der Elektronegativität nicht zu stark unterscheiden, sind die Cycloalkanmoleküle unpolar und haben daher kein Dipolmoment.
Sie können nicht durch Dipol-Dipol-Kräfte interagieren, sondern hängen spezifisch von Londoner Kräften ab, die schwach sind, aber mit der Molekülmasse zunehmen. Deshalb sind kleine Cycloalkane (mit weniger als fünf Kohlenstoffen) gasförmig..
Intermolekulare Wechselwirkungen
Andererseits haben Cycloalkane, da sie Ringe sind, eine größere Kontaktfläche, was die Londoner Kräfte zwischen ihren Molekülen begünstigt. Daher gruppieren und interagieren sie besser als Alkane. und daher sind seine Siede- und Schmelzpunkte höher.
Da sie zwei Wasserstoffatome weniger haben (C.nH.2n für Cycloalkane und C.nH.2n + 2 für Alkane) sind sie leichter; und wenn man die Tatsache seiner größeren Kontaktfläche hinzufügt, nimmt das von seinen Molekülen eingenommene Volumen ab, und daher sind sie dichter.
Sättigung
Warum werden Cycloalkane als gesättigte Kohlenwasserstoffe eingestuft? Weil sie keine Möglichkeit haben, ein Wasserstoffmolekül einzubauen; Wenn der Ring nicht geöffnet wird, werden sie zu einfachen Alkanen. Damit ein Kohlenwasserstoff als gesättigt betrachtet werden kann, muss er die maximal mögliche Anzahl von CH-Bindungen aufweisen.
Stabilität
Chemisch sind sie Alkanen sehr ähnlich. Beide haben C-C- und C-H-Bindungen, die nicht so leicht zu brechen sind, um andere Produkte herzustellen. Ihre relativen Stabilitäten unterscheiden sich jedoch, was experimentell durch Messung ihrer Verbrennungswärme (ΔH) überprüft werden kannKamm).
Zum Beispiel beim Vergleich von ΔHKamm Für Propan und Cyclopropan (im Bild durch ein Dreieck dargestellt) haben wir 527,4 kcal / mol bzw. 498,9 kcal / mol.
Das Detail ist, dass das Cyclopropan, basierend auf den Verbrennungswärmen der Alkane, ein ΔH haben sollteKamm niedriger (471 kcal / mol), weil es sich um drei Methylengruppen handelt, CHzwei;; In Wirklichkeit setzt es jedoch mehr Wärme frei, was auf eine größere Instabilität als geschätzt zurückzuführen ist. Diese überschüssige Energie soll dann auf die Spannungen im Ring zurückzuführen sein..
Tatsächlich bestimmen und differenzieren diese Spannungen die Reaktivität oder Stabilität von Cycloalkanen in Bezug auf Alkane gegenüber spezifischen Reaktionen. Solange die Spannungen nicht sehr hoch sind, neigen Cycloalkane dazu, stabiler zu sein als ihre jeweiligen Alkane..
Nomenklatur
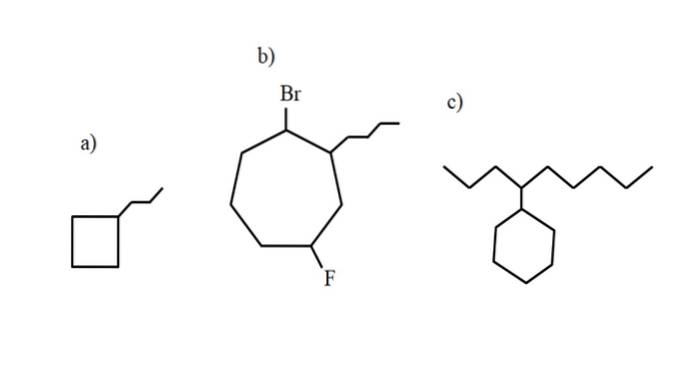
Die IUPAC-Nomenklatur für Cycloalkane unterscheidet sich nicht wesentlich von der für Alkane. Die einfachste Regel von allen ist, das Präfix Cyclo auf den Namen des Alkans zu setzen, aus dem das Cycloalkan gebildet wird.
So beispielsweise aus n-Hexan CH3CHzweiCHzweiCHzweiCHzweiCH3, Sie erhalten Cyclohexan (im ersten Bild durch ein Sechseck dargestellt). Das gleiche passiert mit Cyclopropan, Cyclobutan usw..
Diese Verbindungen können jedoch Substitutionen eines ihrer Wasserstoffatome eingehen. Wenn die Anzahl der Kohlenstoffe im Ring größer ist als die der Alkylsubstituenten, wird der Ring als Hauptkette genommen; Dies ist der Fall von a) für das obige Bild.
Es ist zu beachten, dass in a) das Cyclobutan (das Quadrat) mehr Kohlenstoffe aufweist als die daran gebundene Propylgruppe; dann wird diese Verbindung als Propylcyclobutan bezeichnet.
Wenn es mehr als einen Substituenten gibt, sollten sie in alphabetischer Reihenfolge und so benannt werden, dass sie die niedrigstmögliche Locator-Nummer haben. Zum Beispiel heißt b): 1-Brom-4-fluor-2-butylcycloheptan (und nicht 1-Brom-5-fluor-7-butylcycloheptan, was falsch wäre).
Und schließlich, wenn der Alkylsubstituent mehr Kohlenstoffe als der Ring hat, wird letzterer als die Substituentengruppe der Hauptkette bezeichnet. Daher heißt c): 4-Cyclohexylnonan.
Struktur
Abgesehen von den substituierten Cycloalkanen ist es zweckmäßig, sich nur auf ihre strukturellen Grundlagen zu konzentrieren: die Ringe. Diese wurden im ersten Bild dargestellt.
Ihre Beobachtung kann zu der falschen Vorstellung führen, dass solche Moleküle flach sind; Mit Ausnahme von Cyclopropan sind seine Oberflächen jedoch "zickzackförmig", wobei die Kohlenstoffe in Bezug auf dieselbe Ebene steigen oder fallen.
Dies liegt daran, dass alle Kohlenstoffe zunächst sp-hybridisiert sind.3, und präsentieren daher tetraedrische Geometrien mit Bindungswinkeln von 109,5º. Wenn jedoch die Geometrie der Ringe sorgfältig beobachtet wird, ist es unmöglich, dass ihre Winkel diese sind; Beispielsweise betragen die Winkel innerhalb des Dreiecks von Cyclopropan 60º.
Dies ist als Winkelspannung bekannt. Je größer die Ringe sind, desto näher liegt der Winkel zwischen den C-C-Bindungen bei 109,5º, was zu einer Abnahme der Spannung und einer Erhöhung der Stabilität des Cycloalkans führt..
Ein weiteres Beispiel ist Cyclobutan mit einem Bindungswinkel von 90º. Bereits in Cyclopentan betragen seine Winkel 108º, und von Cyclohexan wird dann gesagt, dass die Winkelspannung aufhört, einen solch bemerkenswerten destabilisierenden Effekt auszuüben.
Konformationen
Neben der Winkelspannung gibt es noch andere Faktoren, die zur Spannung der Cycloalkane beitragen..
Die C-C-Bindungen können sich nicht einfach drehen, da dies bedeuten würde, dass die gesamte Struktur „wackelt“. Somit können diese Moleküle sehr gut definierte räumliche Konformationen annehmen. Der Zweck dieser Bewegungen ist es, die durch die Sonnenfinsternis der Wasserstoffatome verursachten Spannungen zu verringern; das heißt, wenn sie voreinander stehen.
Zum Beispiel ähneln die Konformationen für Cyclobutan einem Schmetterling, der mit den Flügeln schlägt. die von Cyclopentan, einer Hülle; die von Cyclohexan, einem Boot oder Stuhl, und je größer der Ring, desto größer die Anzahl und Form, die sie im Raum annehmen können.
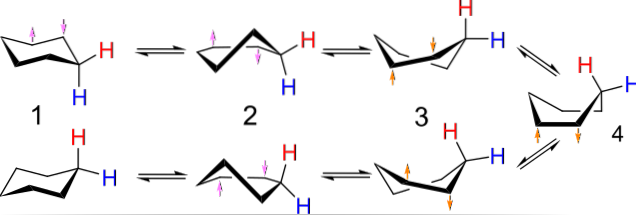
Das obige Bild zeigt ein Beispiel für solche Konformationen für Cyclohexan. Beachten Sie, dass das vermeintlich flache Sechseck eher wie ein Stuhl (links im Bild) oder ein Boot (rechts) aussieht. Ein Wasserstoff wird durch einen roten Buchstaben und ein anderer durch einen blauen Buchstaben dargestellt, um anzuzeigen, wie sich ihre relativen Positionen nach den Inversionen ändern..
In (1) heißt es, wenn Wasserstoff senkrecht zur Ringebene ist, dass er sich in der axialen Position befindet; und wenn es parallel dazu ist, soll es sich in der äquatorialen Position befinden.
Reaktionen
Die Reaktionen, die Cycloalkane eingehen können, sind die gleichen wie bei Alkanen. Beide verbrennen in Gegenwart von überschüssigem Sauerstoff bei typischen Verbrennungsreaktionen unter Bildung von Kohlendioxid und Wasser. Ebenso können beide Halogenierungen eingehen, bei denen ein Wasserstoff durch ein Halogenatom (F, Cl, Br, I) ersetzt wird..
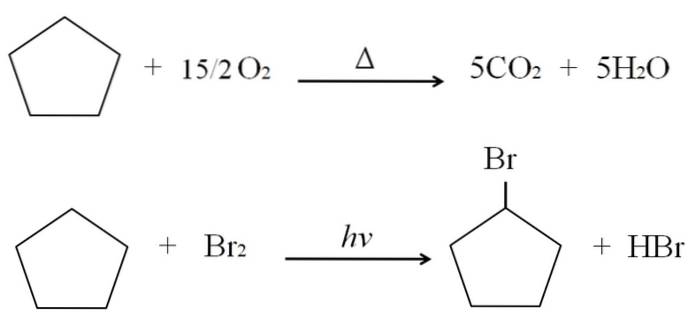
Die Verbrennungs- und Halogenierungsreaktionen für Cyclopentan sind oben als Beispiel gezeigt. Ein Mol davon verbrennt in Gegenwart von Wärme und 7,5 Mol molekularem Sauerstoff, um sich in CO zu zersetzenzwei und H.zweiO. Andererseits ersetzt es in Gegenwart von ultravioletter Strahlung und Brom ein H durch ein H, wobei ein gasförmiges Molekül von HBr freigesetzt wird.
Anwendungen
Die Verwendung von Cycloalkanen hängt stark von ihrer Kohlenstoffzahl ab. Die leichtesten und daher gasförmigsten wurden einst verwendet, um die Gaslampen der öffentlichen Beleuchtung mit Strom zu versorgen.
Flüssigkeiten haben ihrerseits Verwendungsmöglichkeiten als Lösungsmittel für Öle, Fette oder kommerzielle Produkte unpolarer Natur. Unter diesen können Cyclopentan, Cyclohexan und Cycloheptan erwähnt werden. Ebenso werden sie häufig im Routinebetrieb in Erdöllabors oder bei der Formulierung von Kraftstoffen verwendet..
Wenn sie schwerer sind, können sie als Schmiermittel verwendet werden. Andererseits können sie auch das Ausgangsmaterial für die Synthese von Arzneimitteln darstellen; wie Carboplatin, das einen Cyclobutanring in seiner Struktur enthält.
Beispiele für Cycloalkane
Schließlich kehren wir zum Anfang des Artikels zurück: dem Bild mit mehreren unsubstituierten Cycloalkanen.
Um sich Cycloalkane zu merken, denken Sie nur an die geometrischen Figuren: Dreieck (Cyclopropan), Quadrat (Cyclobutan), Pentagon (Cyclopentan), Hexagon (Cyclohexan), Heptagon (Cycloheptan), Decagon (Cyclodecan), Pentadecagon (Cyclopentadecan) und so weiter..
Je größer der Ring ist, desto weniger ähnelt er seiner jeweiligen geometrischen Figur. Es wurde bereits gesehen, dass Cyclohexan alles andere als ein Sechseck ist; das gleiche gilt deutlicher für Cyclotetradecan (vierzehn Kohlenstoffe).
Es kommt ein Punkt, an dem sie sich wie Halsketten verhalten, die gefaltet werden können, um die Belastung ihrer Glieder und das Verfinstern so weit wie möglich zu verringern..
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Chemie LibreTexts. (02. Juni 2019). Cycloalkane benennen. Wiederhergestellt von: chem.libretexts.org
- Wikipedia. (2019). Cycloalkan. Wiederhergestellt von: en.wikipedia.org
- Clark Jim. (2015). Einführung von Alkanen und Cycloalkanen. Wiederhergestellt von: chemguide.co.uk
- James Ashenhurst. (2019). Konformationen und Cycloalkane. Master Organische Chemie. Wiederhergestellt von: masterorganicchemistry.com
- Fernández Germán. (s.f.). Cycloalkan-Theorie. Organische Chemie. Wiederhergestellt von: quimicaorganica.org


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.