
Chemische Struktur, Eigenschaften und Verwendungen von Siliziumkarbid

Das Siliciumcarbid Es ist ein kovalenter Feststoff aus Kohlenstoff und Silizium. Es ist von großer Härte mit einem Wert von 9,0 bis 10 auf der Mohs-Skala, und seine chemische Formel lautet SiC, was darauf hindeuten könnte, dass Kohlenstoff durch eine kovalente Dreifachbindung mit einer positiven Ladung (+) auf Si und a an Silizium gebunden ist negative Ladung (-) auf Kohlenstoff (+Ja≡C-).
Tatsächlich sind die Bindungen in dieser Verbindung völlig unterschiedlich. Es wurde 1824 vom schwedischen Chemiker Jön Jacob Berzelius entdeckt, als er versuchte, Diamanten zu synthetisieren. 1893 entdeckte der französische Wissenschaftler Henry Moissani ein Mineral, dessen Zusammensetzung Siliciumcarbid enthielt.

Diese Entdeckung wurde gemacht, als Gesteinsproben aus dem Krater eines Meteoriten im Devil's Canyon, USA, untersucht wurden. Er nannte dieses Mineral Moissanit. Andererseits entwickelte Edward Goodrich Acheson (1894) eine Methode zur Synthese von Siliciumcarbid, bei der Sand oder hochreiner Quarz mit Petrolkoks umgesetzt wurden..
Goodrich nannte das Produkt Carborundum (oder Carborundium) und gründete eine Firma zur Herstellung von Schleifmitteln.
Artikelverzeichnis
- 1 Chemische Struktur
- 2 Eigenschaften
- 2.1 Allgemeine Eigenschaften
- 2.2 Thermische Eigenschaften
- 2.3 Mechanische Eigenschaften
- 2.4 Elektrische Eigenschaften
- 3 Verwendungen
- 3.1 Als Schleifmittel
- 3.2 In Form von strukturierter Keramik
- 3.3 Andere Verwendungen
- 4 Referenzen
Chemische Struktur
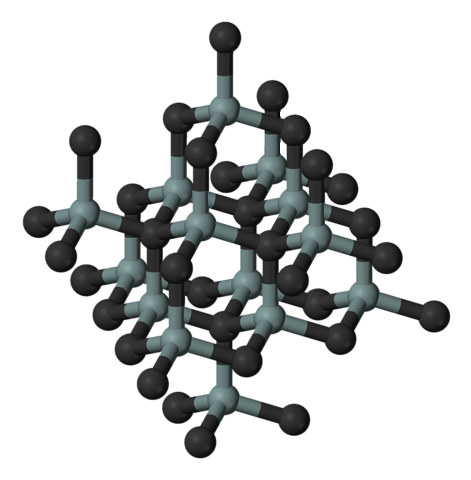
Das obige Bild zeigt die kubische und kristalline Struktur von Siliciumcarbid. Diese Anordnung ist die gleiche wie die von Diamant, trotz der Unterschiede in den Atomradien zwischen C und Si..
Alle Bindungen sind im Gegensatz zu ionischen Festkörpern und ihren elektrostatischen Wechselwirkungen stark kovalent und gerichtet.
SiC bildet molekulare Tetraeder; Das heißt, alle Atome sind an vier andere gebunden. Diese tetraedrischen Einheiten sind durch kovalente Bindungen miteinander verbunden, wobei geschichtete kristalline Strukturen angenommen werden..
Diese Schichten haben auch ihre eigenen Kristallanordnungen, die von drei Typen sind: A, B und C..
Das heißt, eine Schicht A unterscheidet sich von B und die letztere von C. Somit besteht der SiC-Kristall aus dem Stapeln einer Folge von Schichten, wobei das als Polytypismus bekannte Phänomen auftritt..
Beispielsweise besteht der kubische Polytyp (ähnlich dem von Diamant) aus einem Stapel von ABC-Schichten und weist daher eine 3C-Kristallstruktur auf..
Andere Stapel dieser Schichten erzeugen auch andere Strukturen zwischen diesen rhomboedrischen und hexagonalen Polytypen. Tatsächlich sind die kristallinen Strukturen von SiC eine "kristalline Störung"..
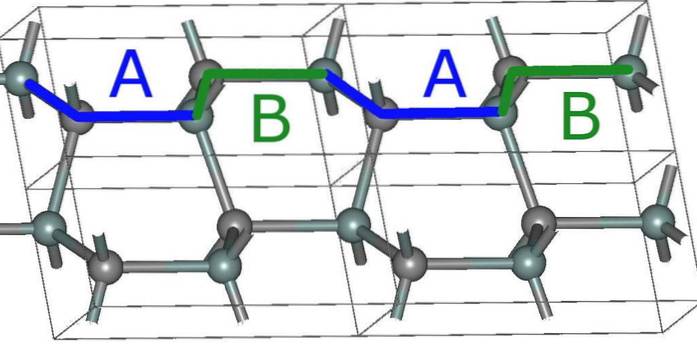
Die einfachste hexagonale Struktur für SiC, das 2H (oberes Bild), entsteht durch das Stapeln der Schichten mit der ABABA-Sequenz ... Nach jeweils zwei Schichten wiederholt sich die Sequenz, und daher kommt die Nummer 2.
Eigenschaften
Allgemeine Eigenschaften
Molmasse
40,11 g / mol
Aussehen
Dies hängt von der Art der Gewinnung und den verwendeten Materialien ab. Es können sein: gelbe, grüne, schwarzblaue oder schillernde Kristalle.
Dichte
3,16 g / cm³
Schmelzpunkt
2830 ºC.
Brechungsindex
2,55.
Kristalle
Es gibt Polymorphismus: hexagonale αSiC-Kristalle und kubische βSiC-Kristalle.
Härte
9 bis 10 auf der Mohs-Skala.
Beständigkeit gegen chemische Arbeitsstoffe
Es ist beständig gegen die Einwirkung starker Säuren und Laugen. Zusätzlich ist Siliciumcarbid chemisch inert..
Thermische Eigenschaften
- Hohe Wärmeleitfähigkeit.
- Hält hohen Temperaturen stand.
- Hohe Wärmeleitfähigkeit.
- Niedriger linearer Wärmeausdehnungskoeffizient, hält also hohen Temperaturen bei geringer Ausdehnung stand.
- Beständig gegen Thermoschock.
Mechanische Eigenschaften
- Hohe Druckfestigkeit.
- Beständig gegen Abrieb und Korrosion.
- Es ist ein leichtes Material von großer Festigkeit und Beständigkeit.
- Erhält seinen elastischen Widerstand bei hohen Temperaturen.
Eigenschaften elektrisch
Es ist ein Halbleiter, der seine Funktionen bei hohen Temperaturen und extremen Spannungen erfüllen kann, ohne dass seine Leistung an das elektrische Feld abgegeben wird..
Anwendungen
Als Schleifmittel
- Siliziumkarbid ist ein Halbleiter, der hohen Temperaturen, hohen Spannungsgradienten oder elektrischen Feldern 8-mal mehr standhalten kann als Silizium. Aus diesem Grund ist es beim Aufbau von Dioden, Transitoren, Suppressoren und Hochenergie-Mikrowellengeräten nützlich..
- Mit der Verbindung wurden Leuchtdioden (LEDs) und Detektoren für die ersten Funkgeräte (1907) hergestellt. Derzeit wurde Siliziumkarbid bei der Herstellung von LED-Lampen durch Galliumnitrid ersetzt, das 10- bis 100-mal helleres Licht emittiert.
- In elektrischen Systemen wird Siliziumkarbid als Blitzableiter in elektrischen Energiesystemen verwendet, da sie seinen Widerstand durch Regulieren der Spannung über ihm regulieren können..
In Form von strukturierter Keramik
- Bei einem als Sintern bekannten Verfahren werden die Siliciumcarbidpartikel - sowie die der Begleiter - auf eine Temperatur erhitzt, die niedriger als die Schmelztemperatur dieser Mischung ist. Somit erhöht es den Widerstand und die Festigkeit des Keramikobjekts durch die Bildung starker Bindungen zwischen den Partikeln..
- Siliziumkarbid-Strukturkeramiken haben ein breites Anwendungsspektrum. Sie werden in Scheibenbremsen und Kraftfahrzeugkupplungen, in Dieselpartikelfiltern und als Additiv in Ölen zur Reibungsreduzierung eingesetzt.
- Die Verwendung von Siliziumkarbid-Strukturkeramik ist in Teilen, die hohen Temperaturen ausgesetzt sind, weit verbreitet. Dies ist beispielsweise beim Hals der Raketeninjektoren und der Walzen der Öfen der Fall..
- Die Kombination aus hoher Wärmeleitfähigkeit, Zähigkeit und hoher Temperaturstabilität macht Komponenten für Wärmetauscherrohre aus Siliziumkarbid..
- Strukturkeramik wird in Sandstrahlinjektoren, Kfz-Wasserpumpendichtungen, Lagern und Extrusionswerkzeugen verwendet. Es ist auch das Material für Tiegel, das beim Metallschmelzen verwendet wird..
- Es ist Teil der Heizelemente, die beim Schmelzen von Glas und Nichteisenmetallen sowie bei der Wärmebehandlung von Metallen verwendet werden.
Andere Verwendungen
- Es kann zur Messung der Temperatur von Gasen verwendet werden. Bei einer als Pyrometrie bekannten Technik wird ein Siliciumcarbidfilament erhitzt und emittiert Strahlung, die mit der Temperatur in einem Bereich von 800 bis 2500 ºK korreliert..
- Es wird in Kernkraftwerken eingesetzt, um das Austreten von durch Spaltung erzeugtem Material zu verhindern.
- Bei der Herstellung von Stahl wird es als Brennstoff verwendet.
Verweise
- Nicholas G. Wright, Alton B. Horsfall. Siliziumkarbid: Die Rückkehr eines alten Freundes. Material Matters Volume 4 Article 2. Abgerufen am 5. Mai 2018 von: sigmaaldrich.com
- John Faithfull. (Februar 2010). Karborundkristalle. Abgerufen am 05. Mai 2018 von: commons.wikimedia.org
- Charles & Colvard. Polytypismus und Moissanite. Abgerufen am 5. Mai 2018 von: moissaniteitalia.com
- Materialwissenschaftler. (2014). SiC2H-StrukturA. [Zahl]. Abgerufen am 05. Mai 2018 von: commons.wikimedia.org
- Wikipedia. (2018). Siliziumkarbid. Abgerufen am 05. Mai 2018 von: en.wikipedia.org
- Navarro SiC. (2018). Siliziumkarbid. Abgerufen am 5. Mai 2018 von: navarrosic.com
- Universität von Barcelona. Siliciumcarbid, SiC. Abgerufen am 05. Mai 2018 von: ub.edu
- CarboSystem. (2018). Siliciumcarbid. Abgerufen am 5. Mai 2018 von: carbosystem.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.