
Struktur, Eigenschaften, Verwendungen und Risiken von Ammoniumacetat
Das Ammoniumacetat ist ein anorganisches Salz, dessen chemische Formel NH ist4CH3COOH. Es wird aus einer Mischung von Essigsäure, die in handelsüblichem Essig in einer Konzentration von 5% enthalten ist, und Ammoniak gewonnen. Beide Ausgangssubstanzen haben charakteristische Gerüche, so dass man sich ein Bild davon machen kann, warum dieses Salz nach Essig-Ammoniak riecht.
Der herausragendste Aspekt dieses Salzes ist jedoch nicht sein Geruch, sondern sein niedriger Schmelzpunkt. Es ist so niedrig, dass es in jedem Labor in seiner flüssigen Version erhalten werden kann, in der Ionen frei fließen, um elektrische Ladungen zu transportieren..

Andererseits zerfällt Ammoniumacetat; Das heißt, es nimmt Wasser oder Feuchtigkeit aus der Umgebung auf, bis es sich vollständig aufgelöst hat. Das ist der Grund, warum die Kristalle im wasserfreien Zustand zwar weiß sind, aber schnell hell werden (wie die im Becher im obigen Bild)..
Als feste Ammoniakquelle sollte es so gehandhabt werden, dass das Einatmen seiner Dämpfe minimiert wird. Trotz dieser negativen Eigenschaft ist der NH4CH3COOH ist nützlich für die Herstellung von Pufferlösungen, die Lebensmittel konservieren, sowie als Bestandteil bestimmter Proteinextraktionslösungsmittel.
Artikelverzeichnis
- 1 Struktur von Ammoniumacetat
- 1.1 Andere Zusammensetzungen und Wasser
- 2 Eigenschaften
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Dichte
- 2.4 Schmelzpunkt
- 2.5 Löslichkeit
- 2.6 Stabilität
- 2,7 pKa
- 2.8 Standardbildungsenthalpie
- 3 Verwendungen
- 3.1 Analytisch
- 3.2 Mittelleiter
- 3.3 Puffer
- 3.4 Auf Eis und Böden
- 3.5 Fällungsmittel
- 3.6 Medizin
- 4 Risiken
- 5 Referenzen
Struktur von Ammoniumacetat
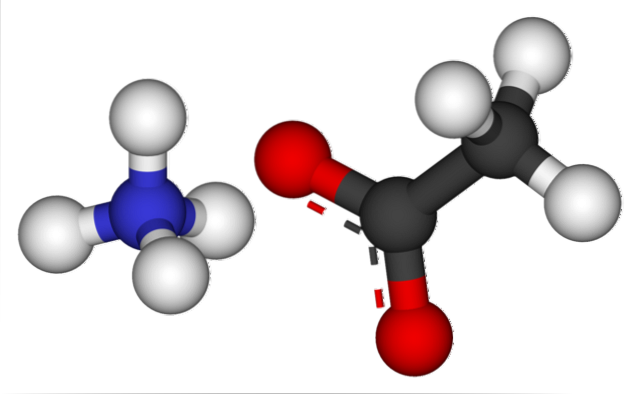
Das Bild oben zeigt die Ionen, aus denen Ammoniumacetat besteht, in einem Kugel- und Stabmodell. Links ist das Kation der tetraedrischen Geometrie NH4+, während rechts das molekulare Anion mit zwei zwischen zwei Sauerstoffatomen delokalisierten Elektronen CH3GURREN- (die gepunktete Linie zwischen den roten Kugeln).
Also beide Ionen, NH4+ und CH3GURREN-, Sie werden durch ihre elektrostatische Anziehung zusammengehalten, die zusammen mit den Abstoßungen zwischen gleichen Ladungen einen Kristall definiert. Dieser Ammoniumacetatkristall hat eine orthorhombische Struktur, die in mikroskopischen Proben oder sogar in sichtbaren Größen beobachtet werden kann..
Für dieses Salz ist nicht nur die Ionenbindung wichtig, sondern auch die Wasserstoffbindung. NH4+ Sie können bis zu vier dieser Brücken spenden. das heißt, in jedem der Eckpunkte seines Tetraeders befindet sich ein Sauerstoffatom von einem CH3GURREN- Nachbar (H.3N.+-H-OCOCH3).
Theoretisch sollten die Kräfte in Ihren Kristallen dann sehr stark sein; experimentell tritt jedoch das Gegenteil auf, da es nur bei 114 ° C schmilzt. Daher kompensieren Wasserstoffbrücken weder die schwache Ionenbindung noch die niedrige Gitterenergie des orthorhombischen NH-Kristalls.4CH3GURREN.
Andere Zusammensetzungen und Wasser
Es wurde ursprünglich gesagt, dass Ammoniumacetat durch Mischen von Essigsäure und Ammoniak hergestellt wird. Daher kann Salz auch ausgedrückt werden als: NH3CH3COOH. Somit können abhängig von der Zusammensetzung andere Strukturen erhalten werden: NH32CH3COOH oder NH35CH3COOH zum Beispiel.
Es wurde auch erwähnt, dass es ziemlich viel Feuchtigkeit aufnimmt. Dabei baut es Wassermoleküle in seine Kristalle ein, die zu NH hydrolysieren3 oder CH3COOH; und deshalb riecht das Salz nach Ammoniak oder Essig.
Eigenschaften
Aussehen
Zerfließende weiße Kristalle mit Essig- und Ammoniakgeruch.
Molmasse
77,083 g / mol.
Dichte
1.073 g / ml bei 25 ° C..
Schmelzpunkt
114 ° C. Dieser Wert ist im Vergleich zu anderen Salzen oder ionischen Verbindungen erheblich niedriger. Außerdem fehlt ihm aufgrund der Bildung von Ammoniak ein Siedepunkt, was die Zersetzung von Salz impliziert..
Löslichkeit
143 g / 100 ml bei 20 ° C. Beachten Sie die außergewöhnliche Löslichkeit in Wasser, die die Affinität von Wassermolekülen zu NH-Ionen zeigt.4+ und CH3GURREN-, Hydratisierung in wässrigen Kugeln.
Seine Löslichkeit ist in weniger polaren Lösungsmitteln nicht so. Beispielsweise werden in 100 ml Methanol bei 15ºC 7,89 g NH gelöst4CH3GURREN.
Stabilität
Es ist zerfließend, daher sollten Sie die Lagerung in feuchten Räumen vermeiden. Während es Wasser absorbiert, setzt es Ammoniak frei und zersetzt sich daher.
pKa
9.9.
Diese Konstante entspricht dem Säuregehalt des Ammoniumions:
NH4+ + B. <=> NH3 + HB
Wo HB eine schwache Säure ist. Wenn es sich bei der Base B um Wasser handelt, hat sie ihre Hydrolysereaktion:
NH4+ + H.zweiODER <=> NH3 + H.3ODER+
In dem die Art H.3ODER+ definiert den pH-Wert der Lösung.
Andererseits trägt Acetat auch zum pH-Wert bei:
CH3GURREN- + H.zweiODER <=> CH3COOH + OH-
Somit sind beide Arten H.3ODER+ und OH- Sie werden neutralisiert und ergeben einen neutralen pH-Wert von 7. Laut Pubchem haben hochkonzentrierte Ammoniumacetatlösungen jedoch einen sauren pH-Wert; was bedeutet, dass die NH-Hydrolyse überwiegt4+ auf der CH3GURREN-.
Standardformationsenthalpie
ΔF.H.298 = -615 kJ / mol.
Anwendungen
Analytisch
Wässrige Lösungen von Natriumacetat ermöglichen die Solubilisierung von Blei, Eisen und Zinksulfaten, um später ihre Konzentration durch Atomabsorptionsspektroskopie zu bestimmen.
Mittlerer Leiter
Da es bei einer niedrigen Temperatur im Vergleich zu anderen Salzen schmilzt, kann seine Flüssigkeit verwendet werden, um den elektrischen Strom zu leiten, der den Stromkreis einer Glühbirne beleuchtet..
Puffer
Es kann pH-Änderungen in sauren oder basischen Bereichen regulieren, wodurch ein konstanter pH-Wert beispielsweise in Fleisch, Pralinen, Käse, Gemüse oder anderen Lebensmitteln aufrechterhalten wird.
Auf Eis und Boden
Es ist ein relativ billiges und biologisch abbaubares Salz, das zum Enteisen vereister Straßen verwendet wird. Da es eine Quelle für wasserlöslichen Stickstoff ist, wird es auch für landwirtschaftliche Zwecke zur Bestimmung des Kaliumspiegels verwendet..
Fällungsmittel
Dieses Salz wird verwendet, um Proteine für die chromatographische Analyse auszufällen..
Medizin
Ammoniumacetat wirkt als Diuretikum in der Veterinärmedizin und ist auch ein notwendiges Salz für die Synthese von Insulin und Penicillin.
Risiken
Nachfolgend und schließlich sind einige Risiken oder negative Folgen aufgeführt, die durch Ammoniumacetat verursacht werden:
- Kann leichte Hautreizungen verursachen, wird aber nicht absorbiert.
- Bei Einnahme verursacht es Magenverstimmung, Durchfall, Diurese, Angstzustände, erhöhten Harndrang, Zittern und andere Symptome im Zusammenhang mit Ammoniakvergiftungen sowie Leberschäden.
- Einatmen reizt Nase, Rachen und Lunge.
Im Übrigen ist nicht bekannt, ob es Krebs verursachen kann, und eine mögliche Brandgefahr durch dieses Salz ist ausgeschlossen (zumindest unter normalen Lagerbedingungen)..
Verweise
- Inger Nahringbauer. (1967). Wasserstoffbrückenbindungsstudien. XIV. Die Kristallstruktur von Ammoniumacetat. Institut für Chemie, Universität Uppsala, Uppsala, Schweden. Acta Cryst. 23, 956.
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Ammoniumacetat. PubChem-Datenbank. CID = 517165. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Sullivan Randy. (2012). Leitfähigkeit von Ammoniumacetat. Wiederhergestellt von: chemdemos.uoregon.edu
- Viachem, Ltd. (s.f.). Ammoniumacetat. Wiederhergestellt von: viacheminc.com
- Wikipedia. (2019). Ammoniumacetat. Wiederhergestellt von: en.wikipedia.org
- Gesundheitsministerium von New Jersey. (2012). Ammoniumacetat - Datenblatt zu gefährlichen Substanzen. [PDF]. Wiederhergestellt von: nj.gov
- Xueyanghu. (s.f.). Verwendung und Risiken von Ammoniumacetat. Wiederhergestellt von: xueyanghu.wordpress.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.