
Änderungen der Zustandstypen und ihrer Eigenschaften (mit Beispielen)

Das Zustandsänderungen oder Phase sind ein thermodynamisches Phänomen, bei dem Materie reversible physikalische Veränderungen erfährt. Es soll thermodynamisch sein, weil eine Wärmeübertragung zwischen Materie und Umgebung stattfindet; oder was auch immer, es gibt Wechselwirkungen zwischen Materie und Energie, die eine Umlagerung der Teilchen induzieren.
Die Partikel, die den Zustandswechsel erfahren, bleiben vor und nach dem Wechsel gleich. Druck und Temperatur sind wichtige Variablen dafür, wie sie in der einen oder anderen Phase untergebracht werden. Wenn eine Zustandsänderung auftritt, wird ein zweiphasiges System gebildet, das aus derselben Materie in zwei verschiedenen physikalischen Zuständen besteht.
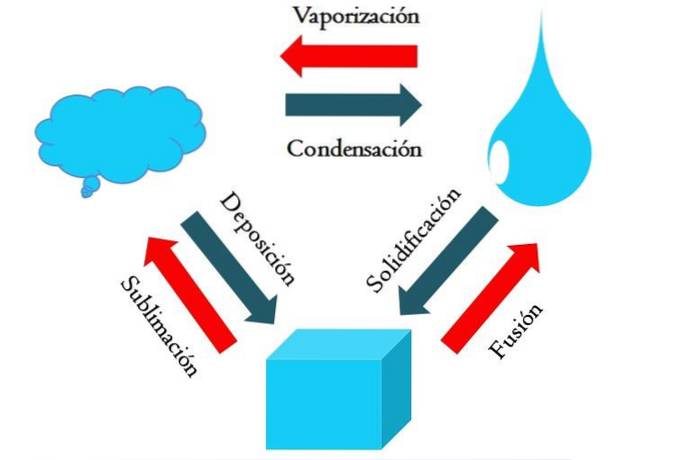
Das Bild oben zeigt die Hauptzustandsänderungen, die Materie unter normalen Bedingungen erfährt..
Ein fester Würfel einer bläulichen Substanz kann je nach Temperatur und Druck seiner Umgebung flüssig oder gasförmig werden. An sich stellt es eine einzelne Phase dar: den Feststoff. Im Moment des Schmelzens, dh des Schmelzens, stellt sich jedoch ein Fest-Flüssig-Gleichgewicht ein, das als Fusion bezeichnet wird (roter Pfeil zwischen dem bläulichen Würfel und dem Tropfen)..
Damit eine Fusion stattfinden kann, muss der Würfel Wärme aus seiner Umgebung absorbieren, um seine Temperatur zu erhöhen. Daher ist es ein endothermer Prozess. Sobald der Würfel vollständig geschmolzen ist, kehrt er zu einer einzigen Phase zurück: der des flüssigen Zustands.
Dieser bläuliche Tropfen kann weiterhin Wärme absorbieren, was seine Temperatur erhöht und zur Bildung von Gasblasen führt. Auch hier gibt es zwei Phasen: eine Flüssigkeit und das andere Gas. Wenn die gesamte Flüssigkeit durch ihren Siedepunkt verdampft ist, soll sie gekocht oder verdampft sein..
Jetzt verwandelten sich die bläulichen Tropfen in Wolken. Bisher waren alle Prozesse endotherm. Das blaue Gas kann weiterhin Wärme absorbieren, bis es heiß wird. Unter den terrestrischen Bedingungen neigt es jedoch dazu, sich abzukühlen und wieder in der Flüssigkeit zu kondensieren (Kondensation)..
Andererseits können Wolken auch direkt auf einer festen Phase abgeschieden werden, wobei wiederum der feste Würfel gebildet wird (Ablagerung). Diese beiden letzten Prozesse sind exotherm (blaue Pfeile); Das heißt, sie geben Wärme an die Umgebung oder die Umgebung ab.
Zusätzlich zur Kondensation und Ablagerung tritt eine Zustandsänderung auf, wenn der bläuliche Tropfen bei niedrigen Temperaturen gefriert (Verfestigung)..
Artikelverzeichnis
- 1 Arten von Zustandsänderungen und ihre Eigenschaften
- 1.1 - Fusion
- 1.2 - Verdampfung
- 1.3 - Kondensation
- 1.4 - Verfestigung
- 1.5 - Sublimation
- 1.6 - Abscheidung
- 2 Andere Statusänderungen
- 3 Referenzen
Arten von Zustandsänderungen und ihre Eigenschaften
Das Bild zeigt typische Änderungen für die drei (häufigsten) Zustände der Materie: fest, flüssig und gasförmig. Die Veränderungen, die von den roten Pfeilen begleitet werden, sind endotherm und beinhalten die Absorption von Wärme. Während diejenigen, die von den blauen Pfeilen begleitet werden, exotherm sind, geben sie Wärme ab.
Im Folgenden wird jede dieser Änderungen kurz beschrieben, wobei einige ihrer Eigenschaften aus molekularen und thermodynamischen Überlegungen hervorgehoben werden..
- Verschmelzung
Fusion ist die Zustandsänderung einer Substanz von fest zu flüssig..
Im festen Zustand sind die Partikel (Ionen, Moleküle, Cluster usw.) "Gefangene", die sich an festen Positionen im Raum befinden, ohne sich frei bewegen zu können. Sie können jedoch mit unterschiedlichen Frequenzen schwingen, und wenn sie sehr stark sind, beginnt die durch intermolekulare Kräfte auferlegte strenge Ordnung „auseinanderzufallen“..
Als Ergebnis werden zwei Phasen erhalten: eine, in der die Partikel eingeschlossen bleiben (fest), und eine andere, in der sie freier sind (flüssig), genug, um die Abstände zu vergrößern, die sie trennen. Um dies zu erreichen, muss der Feststoff Wärme absorbieren, und daher vibrieren seine Partikel mit größerer Kraft..
Aus diesem Grund ist die Fusion endotherm, und wenn sie beginnt, wird gesagt, dass ein Gleichgewicht zwischen den Fest-Flüssig-Phasen auftritt..
Die Wärme, die erforderlich ist, um diese Änderung hervorzurufen, wird als Wärme oder molare Schmelzenthalpie (ΔH) bezeichnetFus). Dies drückt die Wärmemenge (Energie, hauptsächlich in Einheiten von kJ) aus, die ein Mol Substanz im festen Zustand absorbieren muss, um zu schmelzen, und nicht einfach seine Temperatur zu erhöhen.
Schneeball

In diesem Sinne versteht es sich, warum ein Schneeball in der Hand schmilzt (oberes Bild). Schnee nimmt Körperwärme auf, was ausreicht, um die Schneetemperatur über 0 ° C zu erhöhen.
Die Eiskristalle im Schnee absorbieren gerade genug Wärme, um zu schmelzen und damit ihre Wassermoleküle eine unordentlichere Struktur annehmen. Während der Schnee schmilzt, erhöht das gebildete Wasser seine Temperatur nicht, da die gesamte Wärme von der Hand vom Schnee verwendet wird, um das Schmelzen zu vervollständigen.
- Verdampfung

Verdampfung ist die Zustandsänderung einer Substanz vom flüssigen in den gasförmigen Zustand.
Wenn man mit dem Beispiel Wasser fortfährt, jetzt eine Handvoll Schnee in einen Topf legt und das Feuer entzündet, wird beobachtet, dass der Schnee schnell schmilzt. Während sich das Wasser erwärmt, beginnen sich kleine Blasen von Kohlendioxid und anderen möglichen gasförmigen Verunreinigungen darin zu bilden..

Wärme erweitert molekular die ungeordneten Konfigurationen von Wasser, erweitert sein Volumen und erhöht seinen Dampfdruck; Daher gibt es mehrere Moleküle, die infolge zunehmender Verdunstung von der Oberfläche entweichen.
Flüssiges Wasser erhöht seine Temperatur aufgrund seiner hohen spezifischen Wärme (4,184 J / ° C ∙ g) langsam. Es kommt ein Punkt, an dem die von ihm aufgenommene Wärme nicht mehr dazu verwendet wird, die Temperatur zu erhöhen, sondern das Flüssigkeits-Dampf-Gleichgewicht einzuleiten. Das heißt, es beginnt zu kochen und die gesamte Flüssigkeit geht in den gasförmigen Zustand über, während sie Wärme absorbiert und die Temperatur konstant hält.
Hier sehen Sie das intensive Sprudeln auf der Oberfläche des gekochten Wassers (oberes Bild). Die von flüssigem Wasser aufgenommene Wärme, so dass der Dampfdruck seiner beginnenden Blasen gleich dem Außendruck ist, wird als Verdampfungsenthalpie (ΔH) bezeichnetDampf).
Die Rolle des Drucks
Entscheidend ist auch der Druck bei Zustandsänderungen. Wie wirkt es sich auf die Verdampfung aus? Je höher der Druck, desto größer die Wärme, die das Wasser zum Kochen aufnehmen muss, und daher verdampft es über 100 ° C..
Dies liegt daran, dass der Druckanstieg es den Wassermolekülen erschwert, aus der Flüssigkeit in die Gasphase zu entweichen..
Schnellkochtöpfe nutzen diese Tatsache zu ihrem Vorteil, um Lebensmittel in Wasser auf eine Temperatur über ihrem Siedepunkt zu erhitzen..
Andererseits benötigt flüssiges Wasser, da es ein Vakuum oder einen Druckabfall gibt, eine niedrigere Temperatur, um zu kochen und in die Gasphase überzugehen. Wenn das Wasser mit viel oder wenig Druck kocht, muss es seine jeweilige Verdampfungswärme absorbieren, um seine Zustandsänderung zu vervollständigen..
- Kondensation
Kondensation ist die Zustandsänderung eines Stoffes vom gasförmigen in den flüssigen Zustand.

Das Wasser ist verdampft. Was kommt als nächstes? Wasserdampf kann seine Temperatur immer noch erhöhen und zu einem gefährlichen Strom werden, der schwere Verbrennungen verursachen kann..
Nehmen wir jedoch an, dass es stattdessen abkühlt. Wie? Die Abgabe von Wärme an die Umgebung und die Abgabe von Wärme wird als exothermer Prozess bezeichnet.
Durch die Freisetzung von Wärme beginnen sich die sehr energetischen gasförmigen Wassermoleküle zu verlangsamen. Außerdem werden ihre Wechselwirkungen wirksamer, wenn die Temperatur des Dampfes abnimmt. Zuerst bilden sich Wassertropfen, die aus dem Dampf kondensiert werden, gefolgt von größeren Tröpfchen, die von der Schwerkraft angezogen werden.
Um eine bestimmte Dampfmenge vollständig zu kondensieren, müssen Sie bei ΔH dieselbe Energie mit entgegengesetztem Vorzeichen freisetzenDampf;; das heißt, seine Kondensationsenthalpie ΔHCond. Somit wird das inverse Dampf-Flüssigkeits-Gleichgewicht hergestellt.
Feuchte Fenster

An den Fenstern der Häuser selbst ist Kondenswasser zu sehen. In einem kalten Klima kollidiert der im Haus enthaltene Wasserdampf mit dem Fenster, das aufgrund seines Materials eine niedrigere Temperatur als andere Oberflächen hat..
Dort können sich die Dampfmoleküle leichter verklumpen, wodurch eine dünne weißliche Schicht entsteht, die sich leicht von Hand entfernen lässt. Wenn diese Moleküle Wärme abgeben (Erwärmung von Glas und Luft), beginnen sie, mehr Cluster zu bilden, bis die ersten Tropfen kondensieren können (oberes Bild)..
Wenn die Tropfen sehr groß werden, rutschen sie durch das Fenster und hinterlassen eine Wasserspur.
- Erstarrung
Erstarrung ist die Zustandsänderung einer Substanz vom flüssigen in den festen Zustand.

Die Verfestigung erfolgt durch Abkühlen; Mit anderen Worten, das Wasser gefriert. Zum Einfrieren muss Wasser die gleiche Wärmemenge abgeben, die das Eis zum Schmelzen aufnimmt. Diese Wärme wird wiederum als Erstarrungs- oder Gefrierenthalpie ΔH bezeichnetCong (-ΔHFus).
Wenn die Wassermoleküle abkühlen, verlieren sie Energie und ihre intermolekularen Wechselwirkungen werden stärker und gerichteter. Dadurch sind sie dank ihrer Wasserstoffbrückenbindungen angeordnet und bilden sogenannte Eiskristalle. Der Mechanismus, durch den Eiskristalle wachsen, wirkt sich auf ihr Aussehen aus: transparent oder weiß.

Wenn Eiskristalle sehr langsam wachsen, verschließen sie keine Verunreinigungen wie Gase, die sich bei niedrigen Temperaturen in Wasser lösen. Somit entweichen die Blasen und können nicht mit dem Licht interagieren; und folglich haben Sie ein Eis, das so transparent ist wie das einer außergewöhnlichen Eisstatue (oberes Bild).
Das gleiche, was mit Eis passiert, kann mit jeder anderen Substanz passieren, die sich durch Abkühlen verfestigt. Möglicherweise ist dies die komplexeste physikalische Änderung der terrestrischen Bedingungen, da mehrere Polymorphe erhalten werden können.
- Sublimation
Sublimation ist die Zustandsänderung einer Substanz vom festen in den gasförmigen Zustand.
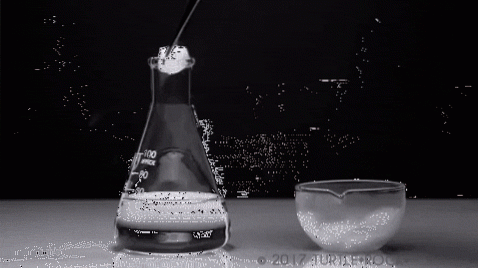
Kann Wasser sublimiert werden? Nein, zumindest nicht unter normalen Bedingungen (T = 25 ° C, P = 1 atm). Damit eine Sublimation stattfinden kann, dh die Zustandsänderung von fest zu gasförmig, muss der Dampfdruck des Feststoffs hoch sein.
Ebenso ist es wichtig, dass ihre intermolekularen Kräfte nicht sehr stark sind, vorzugsweise wenn sie nur aus Dispersionskräften bestehen.
Das emblematischste Beispiel ist festes Jod. Es ist ein kristalliner Feststoff mit grau-violetten Farbtönen, der einen hohen Dampfdruck aufweist. So sehr, dass dabei ein violetter Dampf austritt, dessen Volumen und Ausdehnung beim Erhitzen spürbar wird.

Ein typisches Experiment ist im obigen Bild gezeigt, bei dem festes Jod in einem Glasbehälter verdampft wird. Es ist interessant und auffällig zu beobachten, wie die violetten Dämpfe diffundieren, und der eingeweihte Schüler kann das Fehlen von flüssigem Jod nachweisen.
Dies ist das Hauptmerkmal der Sublimation: Es ist keine flüssige Phase vorhanden. Ebenso ist es endotherm, da der Feststoff Wärme absorbiert, um seinen Dampfdruck zu erhöhen, bis er dem Außendruck entspricht..
- Ablage

Ablagerung ist die Änderung des Zustands einer Substanz vom gasförmigen in den festen Zustand.
Parallel zum Jodsublimationsexperiment gibt es das seiner Abscheidung. Die Ablagerung ist die entgegengesetzte Änderung oder der entgegengesetzte Übergang: Die Substanz geht vom gasförmigen Zustand in den Feststoff über, ohne dass sich eine flüssige Phase bildet.
Wenn lila Joddämpfe mit einer kalten Oberfläche in Kontakt kommen, geben sie Wärme ab, um sie zu erwärmen, verlieren Energie und gruppieren ihre Moleküle wieder in den grau-lila Feststoff (oberes Bild). Es ist dann ein exothermer Prozess.
Die Abscheidung wird häufig für die Synthese von Materialien verwendet, bei denen sie durch ausgefeilte Techniken mit Metallatomen dotiert sind. Wenn die Oberfläche sehr kalt ist, ist der Wärmeaustausch zwischen ihr und den Dampfpartikeln abrupt, wodurch der Durchgang durch die jeweilige flüssige Phase entfällt..
Die Hitze oder Enthalpie der Ablagerung (und nicht Anzahlung) ist die Umkehrung der Sublimation (ΔHSub= - ΔHD.E.P.). Theoretisch können viele Substanzen sublimiert werden, aber um dies zu erreichen, müssen zusätzlich zu ihrem P-T-Diagramm die Drücke und Temperaturen manipuliert werden. in denen seine entfernten möglichen Phasen visualisiert werden können.
Andere Statusänderungen
Obwohl sie nicht erwähnt werden, gibt es andere Materiezustände. Manchmal zeichnen sie sich dadurch aus, dass sie "ein bisschen von jedem" haben und daher eine Kombination von ihnen sind. Um sie zu erzeugen, müssen Drücke und Temperaturen auf sehr positive (große) oder negative (kleine) Größen eingestellt werden..
Wenn beispielsweise Gase übermäßig erhitzt werden, verlieren sie ihre Elektronen und ihre positiv geladenen Kerne in dieser negativen Flut bilden das sogenannte Plasma. Es ist gleichbedeutend mit "elektrischem Gas", da es eine hohe elektrische Leitfähigkeit aufweist.
Wenn andererseits die Temperaturen zu niedrig fallen, kann sich die Materie auf unerwartete Weise verhalten. Das heißt, sie weisen einzigartige Eigenschaften um den absoluten Nullpunkt (0 K) auf..
Eine dieser Eigenschaften ist Superfluidität und Supraleitung; sowie die Bildung von Bose-Einstein-Kondensaten, bei denen sich alle Atome als eins verhalten.
Einige Forschungen weisen sogar auf photonische Materie hin. In ihnen gruppieren sich die Teilchen elektromagnetischer Strahlung, Photonen, zu photonischen Molekülen. Das heißt, es würde theoretisch Lichtkörpern Masse verleihen.
Verweise
- Helmenstine, Anne Marie, Ph.D. (19. November 2018). Liste der Phasenänderungen zwischen Materiezuständen. Wiederhergestellt von :oughtco.com
- Wikipedia. (2019). Aggregatszustand. Wiederhergestellt von: en.wikipedia.org
- Dorling Kindersley. (2007). Status ändern. Wiederhergestellt von: factmonster.com
- Meyers Ami. (2019). Phasenwechsel: Verdampfung, Kondensation, Gefrieren, Schmelzen, Sublimation und Abscheidung. Studie. Wiederhergestellt von: study.com
- Bagley M. (11. April 2016). Materie: Definition und die fünf Zustände der Materie. Wiederhergestellt von: lifescience.com
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.