
Jodgeschichte, Eigenschaften, Struktur, Gewinnung, Risiken, Verwendungen
Das Jod Es ist ein reaktives nichtmetallisches Element, das zur Gruppe 17 des Periodensystems (Halogene) gehört und durch das chemische Symbol I dargestellt wird. Im Wesentlichen ist es ein ziemlich beliebtes Element, vom jodierten Wasser bis zum Hormon Tyrosin.
Im festen Zustand ist Jod dunkelgrau mit einem metallischen Glanz (unteres Bild), der sublimieren kann, um einen violetten Dampf zu erzeugen, der, wenn er auf einer kalten Oberfläche kondensiert, einen dunklen Rückstand hinterlässt. Zahlreiche und attraktive Experimente haben diese Eigenschaften demonstriert.

Dieses Element wurde zum ersten Mal von Bernard Curtois im Jahr 1811 isoliert, während Verbindungen erhalten wurden, die als Rohstoff für die Herstellung von Salpeter dienten. Curtois identifizierte Jod jedoch nicht als ein Element, ein Verdienst, den Joseph Gay-Lussac und Humphry Davy teilten. Gay-Lussac identifizierte das Element als "iode", ein Begriff, der vom griechischen Wort "ioides" stammt, mit dem die Farbe Violett bezeichnet wurde..
Elementares Iod ist wie die anderen Halogene ein zweiatomiges Molekül, das aus zwei Iodatomen besteht, die durch eine kovalente Bindung verbunden sind. Die Van-der-Waals-Wechselwirkung zwischen Jodmolekülen ist die stärkste unter den Halogenen. Dies erklärt, warum Jod das Halogen mit den höchsten Schmelz- und Siedepunkten ist. Außerdem ist es das am wenigsten reaktive der Halogene und das mit der niedrigsten Elektronegativität..
Jod ist ein wesentliches Element, das aufgenommen werden muss, da es für das Körperwachstum notwendig ist. Gehirn und geistige Entwicklung; Stoffwechsel im Allgemeinen usw., wobei eine tägliche Einnahme von 110 µg / Tag empfohlen wird.
Jodmangel im fetalen Zustand einer Person ist mit dem Auftreten von Kretinismus verbunden, einem Zustand, der durch eine Verlangsamung des Körperwachstums gekennzeichnet ist; sowie unzureichende geistige und intellektuelle Entwicklung, Strabismus usw..
In der Zwischenzeit ist ein Jodmangel in jedem Alter des Individuums mit dem Auftreten eines Kropfes verbunden, der durch eine Hypertrophie der Schilddrüse gekennzeichnet ist. Kropf ist eine endemische Krankheit, da er auf bestimmte geografische Gebiete mit eigenen Ernährungsmerkmalen beschränkt ist.
Artikelverzeichnis
- 1 Geschichte
- 1.1 Ermittlung
- 1.2 Entstehung des Namens
- 1.3 Historische Verwendungen
- 2 Physikalische und chemische Eigenschaften
- 2.1 Aussehen
- 2.2 Standardatomgewicht
- 2.3 Ordnungszahl (Z)
- 2.4 Schmelzpunkt
- 2,5 Siedepunkt
- 2.6 Dichte
- 2.7 Löslichkeit
- 2.8 Geruch
- 2,9 Octanol / Wasser-Verteilungskoeffizient
- 2.10 Zersetzung
- 2.11 Viskosität
- 2.12 Dreifachpunkt
- 2.13 Kritischer Punkt
- 2.14 Schmelzwärme
- 2.15 Verdampfungswärme
- 2.16 Molare Wärmekapazität
- 2.17 Dampfdruck
- 2.18 Oxidationszahlen
- 2.19 Elektronegativität
- 2.20 Ionisierungsenergie
- 2.21 Wärmeleitfähigkeit
- 2.22 Elektrischer Widerstand
- 2.23 Magnetische Ordnung
- 2.24 Reaktivität
- 3 Aufbau und elektronische Konfiguration
- 3.1 - Jodatom und seine Bindungen
- 3.2 - Kristalle
- 3.3 - Phasen
- 4 Wo zu finden und zu erhalten
- 4.1 Die Caliche
- 4.2 Die Sole
- 5 Biologische Rolle
- 5.1 - Empfohlene Diät
- 5.2 - Schilddrüsenhormone
- 5.3 - Mangel
- 6 Risiken
- 7 Verwendungen
- 7.1 Ärzte
- 7.2 Reaktionen und katalytische Wirkung
- 7.3 Fotografie und Optik
- 7.4 Andere Verwendungen
- 8 Referenzen
Geschichte
Entdeckung
Jod wurde vom französischen Chemiker Bernard Curtois im Jahr 1811 entdeckt, als er mit seinem Vater bei der Herstellung von Salpeter zusammenarbeitete und dafür Natriumcarbonat benötigte..
Diese Verbindung wurde aus Seetang isoliert, den sie vor den Küsten der Normandie und der Bretagne sammelten. Zu diesem Zweck wurden die Algen verbrannt und die Asche mit Wasser gewaschen, wobei die resultierenden Rückstände durch Zugabe von Schwefelsäure zerstört wurden..
Einmal, vielleicht durch einen zufälligen Fehler, fügte Curtois einen Überschuss an Schwefelsäure hinzu und es bildete sich ein violetter Dampf, der auf den kalten Oberflächen kristallisierte und sich als dunkle Kristalle absetzte. Curtois vermutete, dass er sich in der Gegenwart eines neuen Elements befand und nannte es "Substanz X"..
Curtois entdeckte, dass diese Substanz beim Mischen mit Ammoniak einen braunen Feststoff (Stickstofftriiodid) bildete, der beim geringsten Kontakt explodierte.
Curtois hatte jedoch Einschränkungen, seine Forschung fortzusetzen, und beschloss, Charles Desormes, Nicolas Clément, Joseph Gay-Lussac und André-Marie Ampère Proben seiner Substanz zu geben, um ihre Zusammenarbeit zu erhalten..
Entstehung des Namens
Im November 1813 machten Desormes und Clément Curtois 'Entdeckung öffentlich. Im Dezember desselben Jahres wies Gay-Lussac darauf hin, dass die neue Substanz ein neues Element sein könnte, und schlug den Namen "iode" aus dem griechischen Wort "ioides" vor, das für Violett bestimmt ist..
Sir Humphry Davy, der einen Teil der Probe erhielt, die Curtois Ampère gegeben hatte, experimentierte mit der Probe und stellte eine Ähnlichkeit mit Chlor fest. Im Dezember 1813 war die Royal Society of London an der Identifizierung eines neuen Elements beteiligt.
Obwohl zwischen Gay-Lussac und Davy eine Diskussion über die Identifizierung von Jod entstand, gaben beide zu, dass Curtois der erste war, der es isolierte. 1839 erhielt Curtois schließlich den Montyn-Preis der Royal Academy of Sciences als Anerkennung für die Isolierung von Jod..
Historische Verwendungen
Im Jahr 1839 gab Louis Daguerre Jod seine erste kommerzielle Verwendung und erfand ein Verfahren zur Herstellung von fotografischen Bildern, die als Daguerreotypien bezeichnet werden, auf dünnen Metallblechen..
1905 untersuchte der amerikanische Pathologe David Marine den Jodmangel bei bestimmten Krankheiten und empfahl seine Einnahme.
Physikalische und chemische Eigenschaften
Aussehen

Festes Dunkelgrau mit metallischem Glanz. Bei Sublimation sind die Dämpfe violett (oberes Bild).
Standardatomgewicht
126.904 u
Ordnungszahl (Z)
53
Schmelzpunkt
113,7 ºC
Siedepunkt
184,3 ºC
Dichte
Umgebungstemperatur: 4,933 g / cm3
Löslichkeit
Es löst sich in Wasser unter Bildung brauner Lösungen mit einer Konzentration von 0,03% bei 20 ºC..
Diese Löslichkeit wird erheblich erhöht, wenn zuvor gelöste Iodidionen vorhanden sind, da ein Gleichgewicht zwischen dem I hergestellt wird- und ichzwei um die anionische Spezies I zu bilden3-, welches besser solvatisiert als Jod.
In organischen Lösungsmitteln wie Chloroform, Tetrachlorkohlenstoff und Schwefelkohlenstoff löst sich Jod unter Bildung einer violetten Tönung. Ebenso löst es sich in stickstoffhaltigen Verbindungen wie Pyridin, Chinolin und Ammoniak wieder zu einer braunen Lösung.
Der Unterschied in den Färbungen liegt in der Tatsache, dass das Jod als solvatisierte Moleküle I gelöst istzwei, oder als Frachttransferkomplexe; Letztere treten auf, wenn es sich um polare Lösungsmittel handelt (darunter Wasser), die sich wie Lewis-Basen verhalten, indem sie Elektronen an Jod abgeben.
Geruch
Scharf, irritierend und charakteristisch. Geruchsschwelle: 90 mg / m3 und reizende Geruchsschwelle: 20 mg / m3.
Octanol / Wasser-Verteilungskoeffizient
Log P = 2,49
Zersetzung
Beim Erhitzen zur Zersetzung entsteht ein Rauch aus Jodwasserstoff und verschiedenen Jodidverbindungen..
Viskosität
2,27 cP bei 116 ºC
Dreifacher Punkt
386,65 K und 121 kPa
Kritischer Punkt
819 K und 11,7 MPa
Schmelzwärme
15,52 kJ / mol
Verdampfungswärme
41,57 kJ / mol
Molare Wärmekapazität
54,44 J / (mol K)
Dampfdruck
Jod hat einen moderaten Dampfdruck und sublimiert beim Öffnen des Behälters langsam zu einem violetten Dampf, der Augen, Nase und Rachen reizt..
Oxidationszahlen
Die Oxidationszahlen für Jod sind: -1 (ich-), +1 (I.+), +3 (I.3+), +4 (I.4+), +5 (I.5+), +6 (I.6+) und +7 (I.7+). In allen Iodidsalzen hat Iod wie im Fall von KI eine Oxidationszahl von -1, da wir in ihnen das Anion I haben-.
Jod erhält positive Oxidationszahlen, wenn es mit elektronegativeren Elementen kombiniert wird; zum Beispiel in seinen Oxiden (I.zweiODER5 und ich4ODER9) oder interhalogenierte Verbindungen (I-F, I-Cl und I-Br).
Elektronegativität
2,66 auf der Pauling-Skala
Ionisationsenergie
Erstens: 1.008,4 kJ / mol
Zweitens: 1.845 kJ / mol
Drittens: 3.180 KJ / mol
Wärmeleitfähigkeit
0,449 W / (m K)
Elektrischer widerstand
1,39 107 Ω · m bei 0 ºC
Magnetische Ordnung
Diamagnetisch
Reaktivität
Jod verbindet sich mit den meisten Metallen zu Jodiden und auch mit nichtmetallischen Elementen wie Phosphor und anderen Halogenen. Das Iodidion ist ein starkes Reduktionsmittel, das spontan ein Elektron freisetzt. Die Oxidation von Jodid erzeugt einen bräunlichen Jodton.
Jod ist im Gegensatz zu Jodid ein schwaches Oxidationsmittel; schwächer als Brom, Chlor und Fluor.
Jod mit der Oxidationszahl +1 kann sich mit anderen Halogenen mit der Oxidationszahl -1 zu Jodhalogeniden verbinden; zum Beispiel: Jodbromid, IBr. Ebenso verbindet es sich mit Wasserstoff zu Jodwasserstoff, der nach dem Auflösen in Wasser als Iodwasserstoffsäure bezeichnet wird..
Iodwasserstoffsäure ist eine sehr starke Säure, die durch Reaktion mit Metallen oder deren Oxiden, Hydroxiden und Carbonaten Iodide bilden kann. Jod hat eine Oxidationsstufe von +5 in Jodsäure (HIO)3), das dehydratisiert wird, um Jodpentoxid zu erzeugen (I.zweiODER5).
Struktur und elektronische Konfiguration
- Jodatom und seine Bindungen

Jod im Grundzustand besteht aus einem Atom mit sieben Valenzelektronen, von denen nur eines sein Oktett vervollständigen und mit dem Edelgas Xenon isoelektronisch werden kann. Diese sieben Elektronen sind entsprechend ihrer elektronischen Konfiguration in ihren 5s- und 5p-Orbitalen angeordnet:
[Kr] 4d10 5szwei 5 p5
Daher zeigen I-Atome eine starke Tendenz zur kovalenten Bindung, so dass jedes Individuum acht Elektronen in seiner äußersten Hülle hat. Somit nähern sich zwei I-Atome und bilden die I-I-Bindung, die das zweiatomige Molekül I definiertzwei (oberes Bild); molekulare Einheit von Jod in seinen drei physikalischen Zuständen unter normalen Bedingungen.
Das Bild zeigt Molekül I.zwei dargestellt durch ein räumliches Füllungsmodell. Es ist nicht nur ein zweiatomiges Molekül, sondern auch homonuklear und unpolar; so ihre intermolekularen Wechselwirkungen (I.zwei - ichzwei) werden von den Londoner Dispersionskräften bestimmt, die direkt proportional zu ihrer Molekülmasse und der Größe der Atome sind.
Diese I-I-Bindung ist jedoch schwächer als die der anderen Halogene (F-F, Cl-Cl und Br-Br). Dies ist theoretisch auf die schlechte Überlappung ihrer sp-Hybridorbitale zurückzuführen3.
- Kristalle
Die Molmasse von I.zwei ermöglicht, dass seine Dispersionskräfte gerichtet und stark genug sind, um einen orthorhombischen Kristall bei Umgebungsdruck zu erzeugen. Sein hoher Elektronengehalt bewirkt, dass das Licht endlose Energieübergänge fördert, wodurch die Jodkristalle schwarz färben.
Wenn Jod jedoch sublimiert, zeigen seine Dämpfe eine violette Färbung. Dies deutet bereits auf einen spezifischeren Übergang innerhalb der Molekülorbitale des I hinzwei (diejenigen mit der höchsten Energie oder Anti-Link).
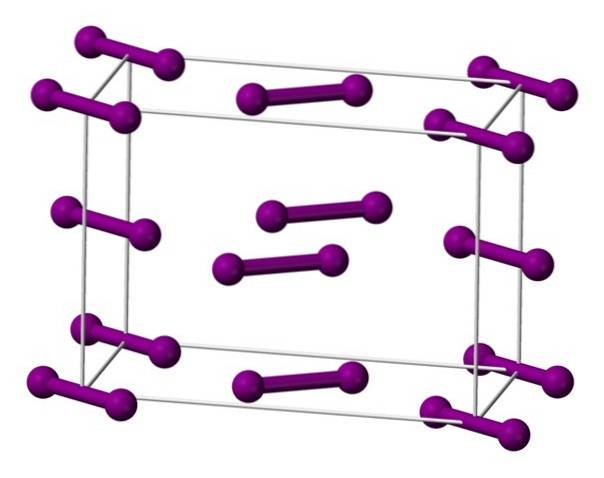
Moleküle I sind oben gezeigtzwei, dargestellt durch ein Modell von Kugeln und Balken, die innerhalb der orthorhombischen Einheitszelle angeordnet sind.
Es ist zu sehen, dass es zwei Schichten gibt: die untere mit fünf Molekülen und die mittlere mit vier. Beachten Sie auch, dass sich ein Jodmolekül an der Basis der Zelle befindet. Glas wird hergestellt, indem diese Schichten periodisch in allen drei Dimensionen verteilt werden..
Wenn man die Richtung parallel zu den I-I-Bindungen durchläuft, wird festgestellt, dass sich die Iodorbitale überlappen, um ein Leitungsband zu erzeugen, das dieses Element zu einem Halbleiter macht. seine Fähigkeit, Elektrizität zu leiten, verschwindet jedoch, wenn die Richtung senkrecht zu den Schichten befolgt wird.
Verbindungsentfernungen
Der I-I-Link scheint erweitert worden zu sein. und tatsächlich ist es, da die Länge seiner Bindung von 266 pm (gasförmiger Zustand) auf 272 pm (fester Zustand) zunimmt.
Dies kann daran liegen, dass in Gas die Moleküle I.zwei sie sind sehr weit voneinander entfernt, ihre intermolekularen Kräfte sind fast vernachlässigbar; Im Festkörper werden diese Kräfte (I-I - I-I) greifbar, ziehen die Iodatome zweier benachbarter Moleküle gegeneinander an und verkürzen folglich den intermolekularen Abstand (oder interatomar, auf andere Weise gesehen)..
Wenn sich der Iodkristall sublimiert, zieht sich die I-I-Bindung in der Gasphase zusammen, da benachbarte Moleküle nicht mehr dieselbe (dispersive) Anziehungskraft auf ihre Umgebung ausüben. Und logischerweise auch die Entfernung I.zwei - ichzwei steigt.
- Phasen
Es wurde bereits erwähnt, dass die I-I-Bindung im Vergleich zu den anderen Halogenen schwächer ist. In der Gasphase bei einer Temperatur von 575 ºC 1% der Moleküle I.zwei sie zerfallen in einzelne I-Atome. Es gibt so viel Wärmeenergie, dass nur zwei Ichs wieder zusammenkommen, sie trennen sich und so weiter.
In ähnlicher Weise kann dieses Aufbrechen der Bindung auftreten, wenn ein enormer Druck auf die Iodkristalle ausgeübt wird. Durch zu starkes Komprimieren (unter Druck hunderttausendmal höher als atmosphärisch) werden die Moleküle I.zwei werden als einatomige Phase I umgeordnet, und Iod soll dann metallische Eigenschaften aufweisen.
Es gibt jedoch andere kristalline Phasen, wie z. B.: Körperzentrierte orthorhombische (Phase II), körperzentrierte tetragonale (Phase III) und flächenzentrierte kubische (Phase IV).
Wo zu finden und zu erhalten
Jod hat ein Gewichtsverhältnis in Bezug auf die Erdkruste von 0,46 ppm und belegt damit den 61. Platz in der Häufigkeit. Jodidmineralien sind rar und kommerziell verwertbare Jodvorkommen sind Jodate..
Jodmineralien kommen in magmatischen Gesteinen mit einer Konzentration von 0,02 mg / kg bis 1,2 mg / kg und in magmatischen Gesteinen mit einer Konzentration von 0,02 mg bis 1,9 mg / kg vor. Es kann auch im Kimmeridge-Schiefer mit einer Konzentration von 17 mg / kg Gewicht gefunden werden.
Darüber hinaus finden sich Jodmineralien in Phosphatgesteinen mit einer Konzentration im Bereich von 0,8 bis 130 mg / kg. Meerwasser hat eine Jodkonzentration zwischen 0,1 und 18 µg / l. Seetang, Schwämme und Austern waren früher die Hauptjodquellen.
Derzeit sind die Hauptquellen jedoch Caliche, Natriumnitratvorkommen in der Atacama-Wüste (Chile) und Sole, hauptsächlich aus dem japanischen Gasfeld in Minami Kanto, östlich von Tokio, und dem Anadarko-Gasfeld. Becken in Oklahoma (USA).
Die Caliche
Das Jod wird in Form von Jodat aus der Caliche extrahiert und mit Natriumbisulfit behandelt, um es zu Jodid zu reduzieren. Die Lösung wird dann mit frisch extrahiertem Iodat umgesetzt, um ihre Filtration zu erleichtern. Caliche war im 19. und frühen 20. Jahrhundert die Hauptquelle für Jod..
Die Sole
Nach der Reinigung wird die Salzlösung mit Schwefelsäure behandelt, die Iodid erzeugt..
Diese Iodidlösung wird anschließend mit Chlor umgesetzt, um eine verdünnte Iodlösung zu erzeugen, die durch einen Luftstrom verdampft wird, der zu einem absorbierenden Turm aus Schwefeldioxid umgeleitet wird, wodurch die folgende Reaktion erzeugt wird:
ichzwei + 2 hzweiO + SOzwei => 2 HI + H.zweiSW4
Anschließend reagiert das Iodwasserstoffgas mit Chlor, um das Iod in gasförmigem Zustand freizusetzen:
2 HI + Clzwei => Ichzwei + 2 HCl
Und schließlich wird das Jod gefiltert, gereinigt und zur Verwendung verpackt..
Biologische Rolle
- Empfohlene Diät
Jod ist ein wesentliches Element, da es in zahlreiche Funktionen von Lebewesen eingreift, die insbesondere beim Menschen bekannt sind. Der einzige Weg für Jod, in den Menschen einzudringen, ist durch das Essen, das er isst.
Die empfohlene Joddiät variiert mit dem Alter. Daher benötigt ein 6 Monate altes Kind eine Aufnahme von 110 µg / Tag; Ab dem 14. Lebensjahr beträgt die empfohlene Diät jedoch 150 µg / Tag. Darüber hinaus wird angegeben, dass die Jodaufnahme 1.100 µg / Tag nicht überschreiten sollte.
- Schilddrüsenhormone
Schilddrüsenstimulierendes Hormon (TSH) wird von der Hypophyse ausgeschieden und stimuliert die Jodaufnahme durch die Schilddrüsenfollikel. Jod wird in die als Kolloide bekannten Schilddrüsenfollikel transportiert, wo es an die Aminosäure Tyrosin unter Bildung von Monoiodotyrosin und Diiodotyrosin bindet..
Im follikulären Kolloid verbindet sich ein Monoiodthyroninmolekül mit einem Diiodthyroninmolekül zu einem Molekül namens Triiodthyronin (T.3). Andererseits können sich zwei Moleküle Diiodotyrosin verbinden und Tetraiodthyronin (T) bilden4). Das t3 und der T.4 werden Schilddrüsenhormone genannt.
T-Hormone3 und T4 Sie werden in Plasma ausgeschieden, wo sie an Plasmaproteine binden. einschließlich Schilddrüsenhormontransporterprotein (TBG). Die meisten Schilddrüsenhormone werden im Plasma als T transportiert4.
Die aktive Form der Schilddrüsenhormone ist jedoch T.3, so die T.4 In den "weißen Organen" der Schilddrüsenhormone wird es deiodiert und in T umgewandelt3 seine hormonelle Wirkung ausüben.
Effekte bearbeiten
Die Wirkung der Wirkung von Schilddrüsenhormonen ist vielfältig, wobei Folgendes hervorgehoben werden kann: erhöhter Stoffwechsel und Proteinsynthese; Förderung des Körperwachstums und der Gehirnentwicklung; erhöhter Blutdruck und Herzfrequenz usw..
- Mangel
Der als Hypothyreose bekannte Mangel an Jod und damit an Schilddrüsenhormonen hat zahlreiche Folgen, die vom Alter der Person beeinflusst werden.
Wenn während des fetalen Zustands einer Person ein Jodmangel auftritt, ist Kretinismus die wichtigste Folge. Dieser Zustand ist durch Anzeichen wie eine beeinträchtigte geistige Funktion, eine verzögerte körperliche Entwicklung, einen Strabismus und eine verzögerte sexuelle Reifung gekennzeichnet..
Ein Jodmangel kann einen Kropf auslösen, unabhängig vom Alter, in dem der Mangel auftritt. Ein Kropf ist eine Überentwicklung der Schilddrüse, die durch eine übermäßige Stimulation der Drüse durch das Hormon TSH verursacht wird, das infolge eines Jodmangels aus der Hypophyse freigesetzt wird..
Die übermäßige Größe der Schilddrüse (Kropf) kann die Luftröhre komprimieren und den Luftdurchgang durch sie einschränken. Darüber hinaus können die Kehlkopfnerven geschädigt werden, was zu Heiserkeit führen kann..
Risiken
Eine Vergiftung durch übermäßige Jodaufnahme kann zu Verbrennungen an Mund, Rachen und Fieber führen. Auch Bauchschmerzen, Übelkeit, Erbrechen, Durchfall, schwacher Puls und Koma.
Ein Überschuss an Jod führt zu einigen Symptomen, die bei einem Mangel beobachtet werden: Es gibt eine Hemmung der Synthese von Schilddrüsenhormonen, die die Freisetzung von TSH erhöht, was zu einer Hypertrophie der Schilddrüse führt; ein Kropf.
Es gibt Studien, die darauf hinweisen, dass eine übermäßige Jodaufnahme Thyreoiditis und papillären Schilddrüsenkrebs verursachen kann. Darüber hinaus kann eine übermäßige Jodaufnahme mit Medikamenten interagieren und deren Wirkung einschränken..
Eine übermäßige Einnahme von Jod in Verbindung mit Antithyreotika wie Methimazol zur Behandlung von Hyperthyreose kann eine additive Wirkung haben und eine Hypothyreose verursachen..
Angiotensin-Converting-Enzym (ACE) -Hemmer wie Benazepril werden zur Behandlung von Bluthochdruck eingesetzt. Die Einnahme von zu viel Kaliumiodid erhöht das Risiko für Hyperkaliämie und Bluthochdruck.
Anwendungen
Ärzte
Jod wirkt als Haut- oder Wunddesinfektionsmittel. Es hat eine fast sofortige antimikrobielle Wirkung, dringt in das Innere von Mikroorganismen ein und interagiert mit Schwefelaminosäuren, Nukleotiden und Fettsäuren, was zum Zelltod führt.
Es übt seine antivirale Wirkung hauptsächlich auf die abgedeckten Viren aus und postuliert, dass es die Proteine auf der Oberfläche der abgedeckten Viren angreift..
Kaliumiodid in Form einer konzentrierten Lösung wird zur Behandlung von Thyreotoxikose verwendet. Es wird auch verwendet, um die Auswirkungen von Strahlung von zu steuern 131Ich blockiere die Bindung des radioaktiven Isotops an die Schilddrüse.
Jod wird zur Behandlung von dendritischer Keratitis eingesetzt. Zu diesem Zweck ist die Hornhaut mit Jod gesättigten Wasserdämpfen ausgesetzt, wodurch vorübergehend das Epithel der Hornhaut verloren geht. aber es gibt eine vollständige Erholung davon in zwei oder drei Tagen.
Auch Jod hat vorteilhafte Wirkungen bei der Behandlung von Mukoviszidose der menschlichen Brust. Ebenso wurde darauf hingewiesen, dass die 131Ich könnte eine optionale Behandlung für Schilddrüsenkrebs sein.
Reaktionen und katalytische Wirkung
Jod wird verwendet, um das Vorhandensein von Stärke festzustellen, was einen blauen Farbton ergibt. Die Reaktion von Jod mit Stärke wird auch verwendet, um das Vorhandensein von gefälschten Banknoten festzustellen, die auf stärkehaltigem Papier gedruckt sind..
Kalium (II) tetraiodmercurat, auch als Nessler-Reagenz bekannt, wird zum Nachweis von Ammoniak verwendet. Ebenso wird im Iodoform-Test eine alkalische Iodlösung verwendet, um das Vorhandensein von Methylketonen zu zeigen..
Anorganische Iodide werden zur Reinigung von Metallen wie Titan, Zirkonium, Hafnium und Thorium verwendet. In einer Stufe des Prozesses müssen die Tetraiodide dieser Metalle gebildet werden.
Jod dient als Stabilisator für Kolophonium, Öl und andere Holzprodukte.
Jod wird als Katalysator in den organischen Synthesereaktionen von Methylierung, Isomerisierung und Dehydrierung verwendet. Inzwischen wird Iodwasserstoffsäure als Katalysator für die Herstellung von Essigsäure in den Monsanto- und Cativa-Verfahren verwendet..
Jod wirkt als Katalysator bei der Kondensation und Alkylierung von aromatischen Aminen sowie bei Sulfatierungs- und Sulfanierungsprozessen und bei der Herstellung von Synthesekautschuken.
Fotografie und Optik
Silberiodid ist ein wesentlicher Bestandteil des traditionellen fotografischen Films. Jod wird zur Herstellung elektronischer Instrumente wie Einkristallprismen, polarisierender optischer Instrumente und Glas verwendet, das Infrarotstrahlen übertragen kann..
Andere Verwendungen
Jod wird zur Herstellung von Pestiziden, Anilinfarbstoffen und Phthalein verwendet. Darüber hinaus wird es bei der Synthese von Farbstoffen verwendet und ist ein Rauchlöschmittel. Und schließlich dient das Silberiodid als Kondensationskern für den Wasserdampf in den Wolken, um Regen zu verursachen..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Stuart Ira Fox (2003). Physiologie des Menschen. Erste Ausgabe. Bearbeiten. McGraw-Hill Interamericana
- Wikipedia. (2019). Jod. Wiederhergestellt von: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi und Onoda Mitsuko. (2003). Modulierte Struktur von festem Jod während seiner molekularen Dissoziation unter hohem Druck. Nature Volume 423, Seiten 971-974. doi.org/10.1038/nature01724
- Chen L. et al. (1994). Strukturelle Phasenübergänge von Jod bei hohem Druck. Institut für Physik, Academia Sinica, Peking. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider & Karl Christe. (26. August 2019). Jod. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- Dr. Doug Stewart. (2019). Jodelement Fakten. Chemicool. Wiederhergestellt von: chemicool.com
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Jod. PubChem-Datenbank. CID = 807. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- F. Rohner, M. Zimmermann, P. Jooste, C. Pandav, K. Caldwell, R. Raghavan & D. J. Raiten (2014). Biomarker der Ernährung für die Entwicklung-Jod-Überprüfung. The Journal of Nutrition, 144 (8), 1322S-1342S. doi: 10.3945 / jn.113.181974
- Advameg. (2019). Jod. Chemie erklärt. Wiederhergestellt von: Chemistryexplained.com
- Traci Pedersen. (19. April 2017). Fakten über Jod. Wiederhergestellt von: lifescience.com
- Megan Ware, RDN, LD. (30. Mai 2017). Alles, was Sie über Jod wissen müssen. Wiederhergestellt von: medicalnewstoday.com
- Nationales Institut für Gesundheit. (9. Juli 2019). Jod. Wiederhergestellt von: ods.od.nih.gov


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.