
Bromthymolblau Struktur, Eigenschaften, Herstellung, Verwendung
Das Bromthymolblau Es ist ein Farbstoff, der gegenüber dem pH-Wert seiner Umgebung empfindlich ist und als Indikator in vielen Laborreaktionen verwendet wurde. Ein Indikator ist ein organischer Farbstoff, dessen Farbe von der Konzentration des H-Ions abhängt.3ODER+ oder der pH-Wert des Mediums. Durch die angezeigte Farbe kann der Indikator den Säuregehalt oder die Basizität der Lösung anzeigen.
Bromthymolblau hat eine aktive Anzeigeskala zwischen pH 6,0 und 7,6. Bei einem pH-Wert des Mediums unter 6,5 zeigt es eine gelbe Färbung. Wenn der pH-Wert des Mediums zwischen 6,5 und 7,6 variiert, erhält es eine grüne Farbe. Bei einem pH-Wert von mehr als 7,6 ist seine Farbe blau.

Diese Eigenschaft macht diesen Indikator sehr nützlich, da er in einer pH-Skala nahe der Neutralität verwendet werden kann; genau dort, wo physiologische Prozesse ablaufen.
Die Ionisation von Bromthymolblau in wässriger Lösung kann wie folgt beschrieben werden:
HIn (gelbe Farbe) + H.zweiODER <=> Im- (blaue Farbe) + H.3ODER+
Wenn der Indikator protoniert ist (HIn), nimmt er eine gelbe Farbe an; während, wenn der deprotonierte Indikator (In-) wird blau.
Artikelverzeichnis
- 1 Chemische Struktur
- 1.1 pH-Änderungen
- 2 Eigenschaften
- 2.1 Chemischer Name
- 2.2 Summenformel
- 2.3 Molekulargewicht
- 2.4 Aussehen
- 2.5 Chemische Eigenschaften
- 2.6 Ionendissoziationskonstante (Ka)
- 2.7 Aktiver Anzeigebereich
- 2.8 Dichte
- 2.9 Schmelzpunkt
- 2.10 Siedepunkt
- 2.11 Löslichkeit
- 2.12 Stabilität
- 2.13 Lichtabsorption
- 3 Verwendungen und Anwendungen
- 3.1 In Stoffwechselstudien
- 3.2 In der Geburtshilfe
- 3.3 Andere Verwendungen
- 4 Vorbereitung
- 5 Referenzen
Chemische Struktur
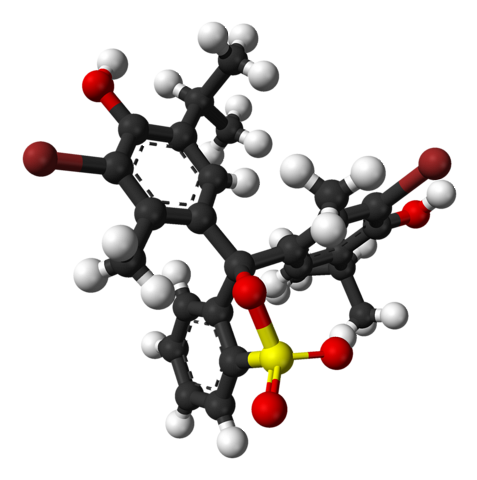
Das obere Bild zeigt die Struktur von Bromthymolblau mit einem Balken- und Kugelmodell bei einem pH-Wert unter 7,1. Die braunen Balken entsprechen insgesamt zwei Bromatomen.
Jeder der drei aromatischen Ringe bildet zusammen mit den Methylgruppen CH3, und tert-Butyl, die Thymolgruppe; und nachdem ein Br verbunden wurde, ergibt sich daraus der Grund, warum es "Bromthymol" genannt wird..
Unten ist die Sulfonatgruppe R-SO gezeigt3-, mit roten und gelben Kugeln. Diese Gruppe kann über ein O-Atom an den zentralen Kohlenstoff gebunden werden, der die drei aromatischen Ringe verbindet.
PH ändert sich
Obwohl sich diese Molekülstruktur mit dem sauren oder basischen pH-Wert nicht radikal ändert, ändern sich ihre elektronischen Zustände, was sich in Änderungen der Farbe der Lösungen widerspiegelt.
Unterhalb von pH 7 ist der Indikator gelb gefärbt und nimmt die Struktur des Bildes an. Wenn der pH-Wert jedoch basisch wird, deprotonieren die -OH-Gruppen und es kann sich eine C = O-Doppelbindung bilden.
Infolgedessen ändert sich das konjugierte System des Moleküls (das aller seiner resonanten Doppelbindungen) so stark, dass die Elektronen nicht mehr dieselben Photonen absorbieren und die Lösung von gelb nach bläulich wechselt..
Wenn andererseits der pH-Wert deutlich unter 7 liegt, ändert sich die Farbe des Indikators von gelb nach rot. Hier ist die Änderung im konjugierten System auf die Protonierung der -OH-Gruppen zu -OH zurückzuführenzwei+. -
Sowohl in sauren als auch in basischen Umgebungen verliert das Molekül an Stabilität und absorbiert Photonen niedrigerer Energie, um die elektronischen Übergänge zu ermöglichen, die für die von den Zuschauern wahrgenommenen Farben verantwortlich sind..
Und was ist mit der grünen Farbe des Hauptbildes? Wenn sich der pH-Wert 7,1 nähert, verliert ein kleiner Teil der Moleküle Protonen und gibt eine blaue Farbe ab, die, wenn sie mit Gelb gemischt wird, die Farbe Grün ergibt..
Eigenschaften
Chemischer Name
Bromthymolblau oder 3,3'-Dibromthymolsulfonaphthalein.
Molekularformel
C.27H.28BrzweiODER5S..
Molekulargewicht
624,384 g / mol.
Aussehen
Festes Pulver mit einer Farbe von rosa bis lila.
Chemische Eigenschaften
Es wirkt als schwache Säure in Lösung. Wenn es in einem sauren Medium protoniert wird, nimmt es eine gelbe Farbe an, bei neutralem pH ist es grün und wenn es in einem alkalischen pH deprotoniert wird, ist es blau.
Ionendissoziationskonstante (Ka)
7,9 x 10-8.
Aktiver Anzeigebereich
pH 6,0 bis 7,6. Dies ist auf das Vorhandensein von Bromatomen, die Elektronen extrahieren, und zwei moderaten Elektronendonorgruppen (Alkylsubstituenten) zurückzuführen..
Dichte
1,25 g / cm3.
Schmelzpunkt
202 ºC (396 º F).
Siedepunkt
184,9 ºC.
Löslichkeit
Es ist in Wasser und Öl schwer löslich. Ebenso ist es in unpolaren Lösungsmitteln wie Benzol, Toluol und Xylol schwer löslich und in Petrolether praktisch unlöslich. Es ist in wässrigen Alkalilösungen und in Alkohol löslich.
Stabilität
Es ist bei Raumtemperatur stabil und mit starken Oxidationsmitteln nicht verträglich.
Lichtabsorption
Die protonierte Form hat ihre maximale Absorption bei einer Wellenlänge (λ) von 427 nm, wodurch gelbes Licht in sauren Lösungen übertragen wird, und die deprotonierte Form hat eine maximale Absorption bei einer Wellenlänge (λ) von 602 nm und überträgt blaues Licht bei alkalischem pH.
Verwendungen und Anwendungen
In Stoffwechselstudien
Bromthymolblau wird in vielen Prozessen verwendet, in denen Kohlendioxid (COzwei) mit der daraus resultierenden Bildung von Kohlensäure (H.zweiCO3), das das Medium ansäuert; Dies zeigt sich in einer Änderung der Färbung von Bromthymolblau.
Wenn eine Person körperliche Bewegung ausübt und an einen Schlauch angeschlossen ist, der wiederum an einen Behälter mit einer Bromthymolblau-Lösung angeschlossen ist, wird das folgende Phänomen beobachtet: Als Folge einer erhöhten körperlichen Aktivität und eines erhöhten Stoffwechsels tritt eine auf Steigerung der Produktion von COzwei.
Der COzwei reagiert mit Wasser unter Bildung von Kohlensäure, H.zweiCO3, welches anschließend dissoziiert und das H-Ion freisetzt+ und Ansäuern des Mediums. Infolgedessen erhält das Bromthymolblau eine gelbe Farbe, wodurch die Säure des Mediums hervorgehoben wird..
In der Geburtshilfe
Bromthymolblau wird in der Geburtshilfe verwendet, um einen frühen Membranbruch zu zeigen. Fruchtwasser hat normalerweise einen pH-Wert von mehr als 7,7, daher wird Bromthymolblau blau, wenn es mit der aus dem Amnion austretenden Flüssigkeit in Kontakt kommt..
Der vaginale pH-Wert ist normalerweise sauer, daher hat Bromthymolblau einen gelben Farbton. Die Änderung der Farbe in Blau unterstreicht das Vorhandensein von Fruchtwasser im Vaginalbereich.
Andere Verwendungen
Bromthymolblau findet auch Anwendung in folgenden Geräten und Funktionen:
-Optische Sensoren
-Gasverbrennungserkennungssysteme
-Bei der Herstellung von Farben, Spielzeug, Reinigungsmitteln, Reinigungsmitteln und Textilien
-Sensoren für die Frische von Lebensmitteln
-Als Griff für frischen und abgestandenen Reis
-Beim Nachweis von Mikroorganismen.
Es wird auch in der Analyse des Bakterienwachstums, in Psychopharmaka und in Dentalmaterialien verwendet..
Vorbereitung
100 mg Bromthymolblau werden in 100 ml verdünntem Alkohol gelöst und gegebenenfalls filtriert. Es wird auch wie folgt hergestellt: 50 mg Bromthymolblau werden in einer Mischung aus 4 ml 0,02 N Natriumhydroxid und 20 ml Alkohol gelöst, wobei mit Wasser bis zu 100 ml aufgefüllt werden.
Verweise
- Wikipedia. (2018). Bromthymolblau. Wiederhergestellt von: en.wikipedia.org
- Foist L. (2018). Bromthymolblau: Definition, Verwendung & Formel. Studie. Wiederhergestellt von: study.com
- Die Wissenschaftsfirma. (2018). Bromthymol Blue pH-Indikator, 1 Unze. Wiederhergestellt von: sciencecompany.com
- Spektrophotometrische Bestimmung des pK des Bromthymolblau-Indikators. Wiederhergestellt von: fch.upol.cz
- PubChem. (2018). Bromthymolblau. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2015). Bromthymolblau. ChemSpider. Wiederhergestellt von: chemspider.com
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.