
Aspergillus terreus Taxonomie, Morphologie und Lebenszyklus
Aspergillus terreus Es ist eine Art Pilz, der Sekundärmetaboliten wie Patulin, Citrinin und Glyotoxine produziert, die für den Menschen schädlich sind. Es ist bekannt für seine Refraktion gegenüber der Amphotericin B-Therapie. Es kann ein opportunistischer Erreger sein, der bei immunsuppressiven Patienten eine invasive Lungenaspergillose verursacht..
A. terreus wird auch verwendet, um "Lovastatin" zu metabolisieren, eine Verbindung, die in der pharmazeutischen Industrie zur Regulierung des Cholesterinspiegels verwendet wird. Es produziert auch vorteilhafte Sekundärmetaboliten wie Terrein, einen Inhibitor der Melanogenese, Asperfuranon und Cyclosporin A, die als Immunsuppressiva verwendet werden..
Sogar einige Stämme werden zur Herstellung von organischen Säuren, Itaconsäuren und Itatartarsäuren durch Fermentationsprozesse verwendet..
Artikelverzeichnis
- 1 Taxonomische Identifizierung von A. terreus
- 2 Morphologie
- 2.1 Makroskopisch
- 2.2 Mikroskopisch
- 3 Lebenszyklus
- 4 Referenzen
Taxonomische Identifizierung von A. terreus
Die Gattung Aspergillus, zu der A. terreus gehört, wurde auf der Grundlage ihrer genomischen DNA umfangreichen taxonomischen Studien unterzogen. Viele dieser Studien haben sich auf bestimmte Gruppen konzentriert (Arten, Abschnitte und Untergattungen)..
A. terreus gehört zur Untergattung Nidulantes der Sektion Terrei. Mit den Fortschritten in molekularbiologischen Studien wurde erkannt, dass es eine genetische Variabilität gibt, die Stämme derselben Art anhand von Proteinmustern unterscheiden kann.
Morphologie
Morphologisch gesehen ist A. terreus ein Fadenpilz, ebenso wie die Arten der Gattung Aspergillus.
Makroskopisch
Makroskopisch kann der Pilz auf speziellen Kulturmedien oder auf den Substraten, auf denen er wächst, charakterisiert werden. Ein Kulturmedium, das im Labor zur Aussaat des Pilzes verwendet wird, ist CYA-Medium (Hefeextrakt-Agar und Czapek) und MEA-Medium (Malzextrakt-Agar), das die Beobachtung der Kolonie, Farbe, des Durchmessers und sogar der Bildung von Strukturen ermöglicht. Reproduktion oder Resistenz , abhängig von den Bedingungen und der Inkubationszeit.
A. terreus wird auf CYA-Medium als kreisförmige Kolonie (30-65 mm Durchmesser) mit einer samtigen oder wolligen Textur, flach oder mit radialen Furchen, mit weißem Myzel beobachtet..
Die Farbe kann von zimtbraun bis gelblichbraun variieren, aber wenn man auf die Rückseite der Kulturplatte schaut, kann sie als gelb, gold oder braun und manchmal mit einem gelben diffusionsfähigen Pigment in der Mitte gesehen werden..
Wenn das Medium MEA ist, sind die Kolonien spärlich, fleischfarben oder hellorange bis orange-grau mit kaum sichtbarem weißem Myzel. Wenn Sie auf die Rückseite der Platte schauen, erscheinen die Kolonien mit gelblichen Tönen..
Mikroskopisch
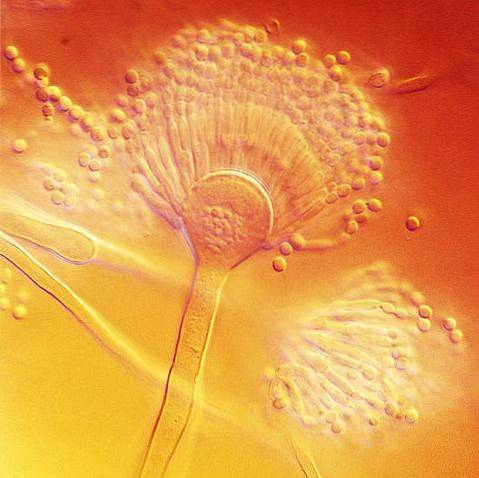
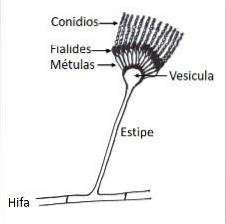
Wie alle Arten der Gattung Aspergillus hat es mikroskopisch spezielle Hyphen, sogenannte Conidiophoren, auf denen sich die konidiogenen Zellen entwickeln, die die Konidien oder asexuellen Sporen des Pilzes bilden..
Der Konidiophor besteht aus drei gut differenzierten Strukturen; das Vesikel, der Stiel und die Fußzelle, die sich mit dem Rest der Hyphen verbindet. Auf dem Vesikel bilden sich konidiogene Zellen, sogenannte Phialide, und je nach Art entwickeln sich zwischen den Vesikeln und den Phialiden andere Zellen, sogenannte Metula..
A. terreus bildet Konidiophoren mit Konidienköpfen in kompakten Säulen mit kugelförmigen oder subglobosen Vesikeln mit einer Breite von 12 bis 20 um. Der Stiel ist hyalin und kann in der Länge von 100 bis 250 um variieren.
Es hat Metula (sogenannte biseriale Konidienköpfe) mit Abmessungen von 5 bis 7 um x 2-3 um und Phialiden von 7 um x 1,5 bis 2,5 um. Die glatten, globosen oder subglobosen Konidien sind im Vergleich zu anderen Aspergillus-Arten klein und können 2 bis 2,5 um messen.
Mit den Fortschritten in der Molekularbiologie und den Sequenzierungstechniken wird heute die Identifizierung von Pilzarten durch die Verwendung molekularer Marker erleichtert, die die Untersuchung von Stämmen einer Art ermöglichen. Derzeit ist der Barcode vieler Pilze die Spacer-Regionen der ribosomalen DNA.
Biologischer Kreislauf
Eine sexuelle Phase und eine asexuelle Phase können identifiziert werden. Wenn eine Spore das ideale Substrat erreicht, ist eine Phase von ungefähr 20 Stunden erforderlich, damit sich die Hyphen entwickeln können.
Bei günstigen Bedingungen wie guter Belüftung und Sonnenlicht beginnen sich die Hyphen zu differenzieren und verdicken einen Teil der Zellwand, aus dem das Konidiophor austritt..
Dadurch entstehen die vom Wind gestreuten Konidien, die den Lebenszyklus des Pilzes neu starten. Wenn die Bedingungen für die vegetative Entwicklung ungünstig sind, wie z. B. lange Stunden der Dunkelheit, kann sich die sexuelle Phase des Pilzes entwickeln.
In der sexuellen Phase entwickeln sich Zellprimordien, die zu einer kugelförmigen Struktur namens Kleistothecia führen. Im Inneren befinden sich die Asci, in denen sich die Ascosporen entwickeln werden. Dies sind die Sporen, die unter günstigen Bedingungen und auf einem geeigneten Substrat Hyphen entwickeln und den Lebenszyklus des Pilzes neu starten.
Verweise
- Samson RA, Visagie CM, Houbraken J., Hong S.-B., Hubka V., Klaassen CHW, Perrone G., Seifert KA, Susca A., Tanney JB, Varga J., Kocsub S., Szigeti G., Yaguchi T. und Frisvad JC… 2014. Phylogenie, Identifizierung und Nomenklatur der Gattung Aspergillus. Studys in Mycology 78: 141 & ndash; 173.
- Es umfasst Mª L. 2000. Taxonomie und Identifizierung von Arten, die an nosokomialer Aspergillose beteiligt sind. Rev. Iberoam Micol 2000; 17: S79-S84.
- Hee-Soo P., Sang-Cheol J., Kap-Hoon H., Seung-Beom H. und Jae-Hyuk Y. 2017. Kapitel Drei. Vielfalt, Anwendungen und synthetische Biologie industriell wichtiger Aspergillus-Pilze. Advances in Microbiology 100: 161 & ndash; 201.
- Rodrigues A.C. 2016. Kapitel 6. Sekundärstoffwechsel und antimikrobielle Metaboliten von Aspergillus. In: Neue und zukünftige Entwicklungen in der mikrobiellen Biotechnologie und Bioengineering. P 81-90.
- Samson RA, Visagie CM, Houbraken S., Hong B., Hubka V., Klaassen CHW, Perrone G., Seifert KA, Susca A., Tanney JB, Verga J., Kocsubé S., Szigeti G., Yaguchi T. und Frisvad JC 2014. Phylogenie, Identifizierung und Nomenklatur der Gattung Aspergillus. Studies in Mycology 78: 141 & ndash; 173.
- Arunmonzhi B. S. 2009. Aspergillus terreus-Komplex. Medizinische Mykologie 47: (Ergänzung 1), S42-S46.
- Narasimhan B. und Madhivathani A. 2010. Genetische Variabilität von Aspergillus terreus aus getrockneten Trauben mittels RAPD-PCR. Fortschritte in Biowissenschaften und Biotechnologie 1: 345-353 ABB.
- Bayram Ö., Braus G.H., Fischer R. und Rodriguez-Romero J. 2010. Übersicht über die photosensorischen Systeme von Aspergillus nidulans. Fungal Genetics and Biology 47: 900 & ndash; 908.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.