
Brilliant Green Agar Foundation, Vorbereitung und Verwendung
Das hellgrüner Agar Es ist ein festes Kulturmedium mit einem hohen Grad an Selektivität. Es wird ausschließlich zur Isolierung von Stämmen der Gattung Salmonella verwendet, es gibt jedoch einige Ausnahmen, wie die Typhi- und Paratyphi-Arten, die in diesem Medium nicht wachsen..
Die Suche nach der Gattung Salmonellen findet sich häufig in Stuhl-, Wasser- oder Lebensmittelproben. In diesem Sinne kann dieses Medium sehr nützlich sein. Dieser Agar wurde 1925 von Kristensen, Lester und Jürgens hergestellt und später von Kauffmann modifiziert.
Es besteht aus Pluripeptonen aus der Magenverdauung von tierischem Gewebe und der Bauchspeicheldrüsenverdauung von Kasein. Es enthält außerdem Hefeextrakt, Natriumchlorid, Laktose, Saccharose, Phenolrot, Hellgrün und Agar-Agar..
Es zeichnet sich dadurch aus, dass es für die meisten Bakterien eine eher unwirtliche Umgebung ist, die das Wachstum von Salmonellen begünstigt. Einige Coliforme können jedoch darin leben und sich schwach entwickeln.
Es ist wichtig zu beachten, dass die Gattung Shigella in dieser Umgebung nicht wächst und auch nicht Salmonella typhimurium, weder Salmonella paratyphi. Wenn Sie diese Mikroorganismen isolieren möchten, sollten Sie daher andere Medien verwenden, z. B. XLD-Agar..
Artikelverzeichnis
- 1 Begründung
- 1.1 Hellgrüner Agar
- 1.2 Varianten von hellgrünem Agar (BGA)
- 2 Vorbereitung
- 3 Verwendungen / Anwendungen
- 4 Qualitätskontrolle
- 5 Referenzen
Basis
Hellgrüner Agar
Jede der Komponenten, aus denen das Medium besteht, erfüllt eine bestimmte Funktion, die die Eigenschaften und Eigenschaften des Agars bestimmt..
Pluripeptone und Hefeextrakt sind die Nährstoffquelle, aus der Mikroorganismen den für ihre Entwicklung notwendigen Stickstoff und die Mineralien aufnehmen. Laktose und Saccharose sind Energiequellen für Mikroorganismen, die sie fermentieren können..
Hellgrün ist die hemmende Substanz, die das Wachstum von grampositiven Bakterien und einer großen Anzahl von gramnegativen Mikroorganismen verhindert..
Natriumchlorid verleiht dem Medium osmotische Stabilität. Während Phenolrot der pH-Indikator ist, ändert es seine Farbe, wenn die Produktion von Säuren aus der Fermentation von Kohlenhydraten nachgewiesen wird..
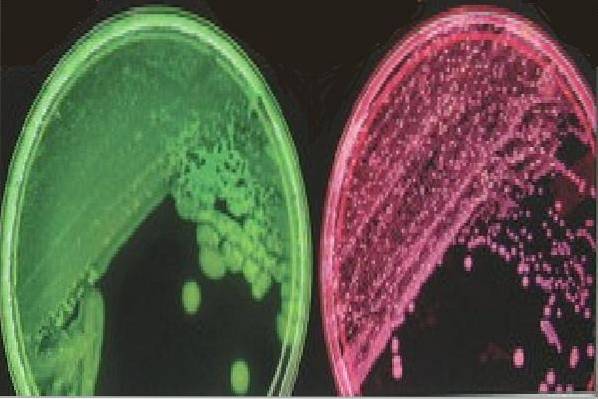
Die nicht fermentierenden Kolonien von Laktose und Saccharose wachsen auf diesem Medium in einer rosa oder transparenten weißen Farbe auf einem roten Hintergrund. Zum Beispiel Bakterien der Gattung Salmonella.
Während laktose- oder saccharosefermentierende Bakterien, die auf diesem Medium wachsen können, grünlich-gelbe oder gelblich-grüne Kolonien auf einem grünlich-gelben Hintergrund entwickeln. Beispielsweise, Escherichia coli und Klebsiella pneumoniae.
Hellgrüne Agar (BGA) -Varianten
Es gibt andere Varianten von hellgrünem Agar; Novobiocin Brilliant Green Glucose (NBG) -Agar und Novobiocin Brilliant Green Glycerol Lactose (NBGL) Agar.
Novobiocin Hellgrüner Glukose-Agar (NBG)
Enthält Trypticase-Soja-Agar, Eisenammoniumcitrat, Natriumthiosulfat-Pentahydrat, Phenolrot, Glucose, Hellgrün, Novobiocin und destilliertes Wasser.
Es wird zur Isolierung von Salmonellenkolonien aus Stuhlproben verwendet.
In diesem Fall sind Hellgrün und Novobiocin die hemmenden Substanzen, die das Wachstum von grampositiven Bakterien und einigen gramnegativen Mikroorganismen verhindern..
Natriumthiosulfat ist die Sulfidquelle und Eisen (III) -citrat ist die Eisenquelle, die beide erforderlich sind, um die Schwefelwasserstoffproduktion durch Bildung eines schwarzen Eisensulfidniederschlags aufzudecken..
Glucose ist das fermentierbare Kohlenhydrat und Phenolrot ist der pH-Indikator..
In diesem Medium entwickeln sich Salmonellenkolonien groß mit einem schwarzen Zentrum, das von einem rötlichen Heiligenschein umgeben ist, gefolgt von einem klar sichtbaren Bereich. Einige Stämme von Citrobacter freundii produzieren Kolonien, die mit Salmonellen identisch sind.
Novobiocin Brilliant Green Glycerol Lactose Agar (NBGL)
Dieses Medium enthält Trypticase-Soja-Agar, Eisenammoniumcitrat, Natriumthiosulfat, Lactose, Glycerin, hellgrün, Novobiocin und destilliertes Wasser..
Der Unterschied zwischen diesem und dem vorherigen Medium besteht darin, dass Glucose durch Lactose ersetzt wird und Glycerin und Phenolrot nicht verwendet werden..
Das Medium wird auch zur Isolierung von Salmonella-Arten verwendet, die Kolonien entwickeln sich aufgrund der Produktion von Schwefelwasserstoff schwarz.
Nur Kolonien, die keine Säure aus Glycerin oder Lactose produzieren, erreichen eine H-ProduktionzweiDies ist ausreichend, da der niedrige pH-Wert die Bildung von H störtzweiS. Dies führt zu farblosen Kolonien für die meisten Proteus- und Citrobacter-Arten..
Vorbereitung
-58 g des kommerziell erhaltenen dehydratisierten Mediums werden gewogen. Fügen Sie es einem Liter redestilliertem Wasser hinzu. Mischen, einige Minuten stehen lassen und das Präparat unter eine Wärmequelle stellen, bis es sich vollständig aufgelöst hat..
-15 Minuten bei 121 ° C autoklavieren, die Sterilisationszeit nicht überschreiten.
-Heiß stehen lassen und heiß in sterilen Petrischalen servieren. Der endgültige pH-Wert sollte 6,9 ± 0,2 betragen.
-Erstarren lassen und bis zur Verwendung im Kühlschrank aufbewahren. Vor dem Säen sollten die Platten Raumtemperatur haben.
-Das pulverförmige Medium hat eine grüne Farbe und wird je nach pH-Wert und Handelsunternehmen orange-braun oder rot-grün gefärbt. Eine sehr braune Farbe zeigt an, dass der Agar überhitzt war..
-Sobald sich der Agar verfestigt hat, wird eine Neufassung nicht empfohlen, da sich das Medium verschlechtert..
Verwendungen / Anwendungen
Mit diesem Medium wird unter anderem nach Stämmen der Gattung Salmonella aus Stuhlproben und Milchprodukten gesucht..
Da es sich um eine eher unwirtliche Umgebung handelt, ist es ratsam, ein reichlich vorhandenes Inokulum zu säen, wenn die direkte Probe verwendet wird. Andernfalls sollte vor der Aussaat in diesem Medium eine Voranreicherung und Anreicherung der Exemplare erfolgen..
Da einige Salmonellenstämme gehemmt sind oder nur schwer wachsen, wird empfohlen, dieses Medium mit einem anderen selektiven Agar für Salmonellen zu begleiten.
Jede Kolonie mit einem typischen Salmonellenmerkmal muss zur endgültigen Identifizierung biochemischen Tests unterzogen werden..
QA
Um die gute Leistung des hellgrünen Agarmediums zu testen, können ATCC-Stämme verwendet werden, um ihre Entwicklung darauf zu beobachten..
Die am häufigsten zur Qualitätskontrolle verwendeten Stämme sind: Salmonella enteritidis ATCC 13076, Salmonella typhimurium ATCC 14028, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 700603, Escherichia coli ATCC 25922, Shigella flexneri ATCC 12022, Staphylococcus aureus ATCC 6538.
Die ersten 3 sollten rosa oder transparente weiße Kolonien auf rotem Grund ergeben. Salmonellen mit guter Entwicklung und Proteus mit schlechtem oder regelmäßigem Wachstum.
Für Klebsiella und Escherichia werden grünlich-gelbe Kolonien mit gelbem Hintergrund erwartet, die bei Shigella und Staphylococcus gehemmt werden sollten.
Das dehydrierte Medium muss bei Raumtemperatur an einem trockenen Ort gelagert werden, da das Medium sehr hygroskopisch ist.
Verweise
- Laboratorio Difco Francisco Soria Melguizo S.A. Brillanter grüner Agar. 2009
- Britannia Laboratory. Hellgrüner Agar. 2015..
- BD Labor. BD Brilliant Green Agar. 2013.
- Koneman E., Allen S., Janda W., Schreckenberger P., Winn W. (2004). Mikrobiologische Diagnose. (5. Aufl.). Argentinien, Editorial Panamericana S.A..
- Forbes B, Sahm D, Weißfeld A. 2009. Mikrobiologische Diagnose von Bailey & Scott. 12 ed. Argentinien. Editorial Panamericana S.A.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.