
M.R.S Agar Grundierung, Vorbereitung und Verwendung

Das Agar M.R.S.. ist ein selektives festes Kulturmedium, das zur Isolierung und Zählung von Milchsäurebakterien, insbesondere der Gattung Lactobacillus, verwendet wird. Dieser Agar wurde 1960 von Man, Rogosa und Sharpe mit demselben Namen hergestellt, aber aufgrund seiner Komplexität wird häufig die Abkürzung M.R.S verwendet..
Es besteht aus Proteosepepton, Fleischextrakt, Hefeextrakt, Glucose, Sorbitanmonoleat, Dikaliumphosphat, Natriumacetat, Ammoniumcitrat, Magnesiumsulfat, Mangansulfat und Agar..

Diese Zusammensetzung ermöglicht die ordnungsgemäße Entwicklung von Milchsäurebakterien aus klinischen Proben wie Kot, Vaginalausfluss, oralen Proben und Muttermilch sowie Milch- und Fleischnahrungsmitteln.
Es wird nicht routinemäßig in klinischen Labors eingesetzt, da Milchsäurebakterien selten an Krankheitsprozessen beteiligt sind. Auf dem Gebiet der Lebensmittelmikrobiologie ist die Verwendung von M.R.S-Agar jedoch häufiger..
Andererseits wird dieses Medium von einigen Forschungszentren verwendet, deren Ziel die Untersuchung von Milchsäurebakterien ist..
Artikelverzeichnis
- 1 Begründung
- 2 Vorbereitung
- 3 Verwendungen
- 3.1 Merkmale der Kolonien
- 3.2 Isolierung von Milchsäurebakterien
- 3.3 Anzahl der Milchsäurebakterien
- 3.4 Auf Forschungsebene
- 4 Qualitätskontrolle
- 5 Referenzen
Basis
Man-, Rogosa- und Sharpe-Agar haben eine ziemlich komplexe Zusammensetzung. Indem die Funktion jeder ihrer Komponenten aufgeschlüsselt wird, kann ihre Basis erklärt werden.
Proteose-Pepton, Fleischextrakt, Hefeextrakt und Glukose sind Nährstoffe, die die Quelle für Kohlenstoff, Stickstoff, Vitamine und Mineralien darstellen, die für das Bakterienwachstum erforderlich sind. Darüber hinaus ist Glukose die universelle Energiequelle, die in den meisten Kulturmedien verwendet wird..
Andererseits ist zur Förderung des Wachstums von Milchsäurebakterien das Vorhandensein von Cofaktoren (Kationen) erforderlich, die für den Metabolismus von Lactobacillus und verwandten Bakterien wesentlich sind; Diese Verbindungen sind die Salze von Natrium, Magnesium und Mangan.
Ebenso sind Sorbitanmonoleat oder Polysorbat 80 eine wichtige Quelle für Fettsäuren, da sie als Nährstoffe absorbiert werden..
Darüber hinaus hemmen Sorbitanmonoleat und Ammoniumcitrat die Entwicklung der begleitenden Flora, insbesondere der gramnegativen Bakterien, und verleihen ihnen den selektiven Charakter dieses Agars..
Schließlich ist der Agar-Agar derjenige, der dem Medium die feste Konsistenz verleiht.
Es gibt andere Varianten von Man Rogosa Sharpe-Agar; einer von ihnen ist mit Cystein (M.R.S.c.) ergänzt, das unter anderem für die Isolierung von Bifidobakterien sehr nützlich ist. Zum anderen gibt es das MRS-Medium, das mit Neomycin, Paromomycin, Nalidixinsäure und Lithiumchlorid ergänzt ist, insbesondere zur selektiven Zählung von Bifidobakterien in Milchprodukten..
Vorbereitung
68,25 g des dehydrierten Mediums werden abgewogen und in einem Liter destilliertem Wasser gelöst. 5 Minuten stehen lassen. Um sich vollständig aufzulösen, wenden Sie sich unter häufigem Rühren an eine Wärmequelle und kochen Sie 1 bis 2 Minuten lang. Im Autoklaven 15 Minuten bei 121 ° C sterilisieren.
Wenn Sie den Autoklaven verlassen, einige Minuten stehen lassen und noch heiß in sterilen Petrischalen verteilen..
Lassen Sie die Platten erstarren und umdrehen, bestellen Sie sie in Plattengestellen und kühlen Sie sie bis zur Verwendung. Lassen Sie die Platten vor Gebrauch auf Raumtemperatur kommen.
Der pH-Wert des Mediums sollte 6,4 ± 0,2 betragen. Einige Handelshäuser empfehlen einen pH-Wert zwischen 5,5 und 5,9.
Das dehydrierte Medium ist beige und hergestellt aus dunklem Bernstein.
Sowohl das dehydrierte Medium als auch die vorbereiteten Platten sollten bei 2 bis 8 ° C gelagert werden..
Anwendungen
Die M.R.S. Sie können auf die Oberfläche gesät werden (Erschöpfung oder mit Drigalski-Spatel). Es kann auch nach Tiefe gesät werden. Die Platten sollten bei 37 ° C in Mikroaerophilie (4% O) inkubiert werdenzwei und 5-10% COzwei) für 24 bis 72 Stunden.
Die Aussaatmethode richtet sich nach dem verfolgten Zweck (Isolierung oder Zählung)..
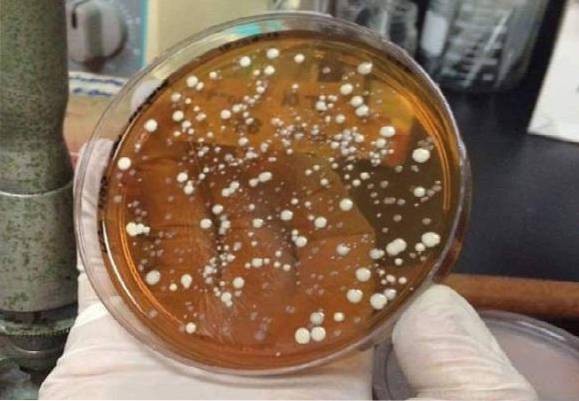
Eigenschaften der Kolonien
Vermutliche Lactobacillus-Kolonien werden weißlich und haben auf diesem Agar ein schleimiges oder cremiges Aussehen. Später müssen sie identifiziert werden.
Isolierung von Milchsäurebakterien
Hierzu wird Surface Seeding verwendet. Die zu säenden Proben erfordern ein vorheriges Verfahren.
Bei Muttermilchproben wird empfohlen, 1 ml der Probe 10 Minuten bei 14.000 U / min zu zentrifugieren, um die Fettschicht zu entfernen. 900 & mgr; l werden verworfen und in den verbleibenden 100 & mgr; l wird das Pellet suspendiert und auf die Oberfläche des M.R.S. Es sollte dann mit einem Drigalski-Spatel gleichmäßig verteilt werden..
Bei Stuhlproben wird ein (1) Gramm Stuhl gewogen und in 9 ml 0,1% igem sterilem Peptonwasser homogenisiert, was einer Verdünnung von 1/10 entspricht. Dann werden Reihenverdünnungen durchgeführt, bis eine endgültige Verdünnung von 10 erreicht ist-4.
Schließlich werden 100 μl der 10 Verdünnungen entnommen-zwei, 10-3 und 10-4 und jede Verdünnung wird auf MRS-Agar ausgesät und gleichmäßig mit einem Drigalski-Spatel verteilt.
Milchsäurebakterien zählen
In diesem Fall erfolgt die Aussaat nach Tiefe.
Für Muttermilchproben wird 1 ml entnommen und in ein steriles konisches Kunststoffröhrchen gegeben. MRS-Agar wird bei einer ungefähren Temperatur von 40 ° C bis zu einem Endvolumen von 25 ml zugegeben, wobei eine homogene Mischung erhalten wird. Anschließend wird es gleichmäßig in sterile Petrischalen gegossen und bis zur Polymerisation ruhen gelassen..
Für Stuhlproben werden Verdünnungen wie zuvor beschrieben durchgeführt. Nehmen Sie 1 ml jeder Verdünnung und geben Sie sie in sterile konische Kunststoffröhrchen. Geschmolzener MRS-Agar wird zu einem Volumen von 25 ml gegeben.
Die Mischung aus jeder Verdünnung wird gleichmäßig in sterile Petrischalen gegossen. Schließlich wird es bis zu seiner Polymerisation ruhen gelassen.
Forschungsniveau
Mit jedem Tag gewinnt das Studium von Milchsäurebakterien an Interesse; Die Forscher möchten unter anderem neue Stämme und ihr Potenzial als Starterfermente für die Standardisierung bei der Herstellung von Milchprodukten kennenlernen..
In diesem Sinne haben Alvarado et al. (2007) verwendeten M.R.S. eine Studie durchzuführen, in der sie Milchsäurebakterien isolierten, identifizierten und charakterisierten, die in einem handwerklich geräucherten venezolanischen Andenkäse vorhanden sind.
Im Käse fanden sie das Vorhandensein von Bakterien der Gattungen Lactococcus und Lactobacillus und kamen zu dem Schluss, dass die Mischungen isolierter Stämme als Starterstämme bei der Herstellung von Käse aus pasteurisierter Milch geeignet sind..
Auf der anderen Seite haben Sánchez et al. (2017) verwendeten M.R.S. das Vorhandensein von Milchsäurebakterien im Verdauungstrakt von Ferkeln zu untersuchen, um sie als native Probiotika zu verwenden, die die Produktivität gesunder Ferkel steigern.
Mit diesem Medium gelang es ihnen, vier Arten zu isolieren: Lactobacillus johnsonii, Lactobacillus brevis, Enterococcus hirae Y. Pediococcus pentosaceus.
Ebenso haben Báez et al. (2019) verwendeten M.R.S. Bewertung von Milchsäurebakterien (LAB) und Bifidobakterien mit probiotischem Potenzial in Muttermilch und Säuglingskot.
Es gelang ihnen, 11 BAL und 3 zu isolieren Bifidobacteria sp in der Muttermilch und 8 BAL und 2 Bifidobacteria sp. im Kot. Alle erfüllten bestimmte Parameter, die sie als Bakterien mit probiotischer Aktivität beweisen.
Die Autoren kamen zu dem Schluss, dass sowohl Muttermilch als auch der Kot ausschließlich gestillter Säuglinge als natürliche Quellen für probiotische Bakterien dienen..
QA
Um die Qualität von M.R.S. Kontrollstämme wie:
Lactobacillus fermentum ATCC 9338, Lactobacillus casei ATCC 393, Bifidobacterium bifidum ATCC 11863, Lactobacillus plantarum MKTA 8014, Lactobacillus lactis MKTA 19435, Pediococcus damnosus MKTA 29358, Escherichia coli und Bacillus cereus.
Die erwarteten Ergebnisse sind ein zufriedenstellendes Wachstum für die ersten 6 Bakterien E coli Y. Bacillus cereus muss vollständig gehemmt werden.
Verweise
- Alvarado C, Chacón Z, Otoniel J, Guerrero B, López G. Isolierung, Identifizierung und Charakterisierung von Milchsäurebakterien aus einem venezolanischen geräucherten Anden-Handwerker-Käse. Seine Verwendung als Starterkultur. Cient. (Maracaibo) 2007; 17 (3): 301 & ndash; 308. Verfügbar unter: scielo.org.
- Sánchez H., Fabián F., Ochoa G., Alfaro-Isolierung von Milchsäurebakterien aus dem Verdauungstrakt des Ferkels. Rev. Investiga. Tierarzt. Peru 2017; 28 (3): 730 & ndash; 736. Verfügbar unter: scielo.org.
- Báez E., González G., Hernández G., López E., Mega M. Bewertung von Milchsäurebakterien und Bifidobakterien mit probiotischem Potenzial in Muttermilch und Kot von Säuglingen in der Gemeinde Acevedo, Miranda 2017. Bachelor-Arbeit zur Qualifikation für den Bachelor-Abschluss in Bioanalyse . Universität von Carabobo, Venezuela.
- Britannia Laboratory. M. R. S. Agar. 2015. Verfügbar unter: britanialab.com
- Wikipedia-Mitwirkende. MRS-Agar. Wikipedia, die freie Enzyklopädie. 10. Januar 2018, 19:44 UTC. Verfügbar unter: wikipedia.org Zugriff am 17. Februar 2019.
- Roy D. Medien zur Isolierung und Zählung von Bifidobakterien in Milchprodukten. Int J Food Microbiol, 200128; 69 (3): 167 & ndash; 82.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.