
Hektoen Agar Grundierung, Vorbereitung und Verwendung

Das Hektoen Agar oder enterischer Hektoen-Agar ist ein festes, selektives und differenzielles Kulturmedium. Es wurde am Hektoen-Institut von King und Metzger zur Isolierung enteropathogener Bakterien der Gattungen Shigella und Salmonella entwickelt.
Das Medium besteht aus Proteosepepton, Hefeextrakt, Gallensalzen, Lactose, Saccharose, Salicin, Natriumthiosulfat, Natriumchlorid, Eisencitrat, Ammoniumcitrat, Bromthymolblau, saurem Fuchsin und Agar. Diese Formulierung ermöglicht es, die Gattungen Shigella und Salmonella von den übrigen Bakterien zu unterscheiden, die in diesem Medium wachsen können..
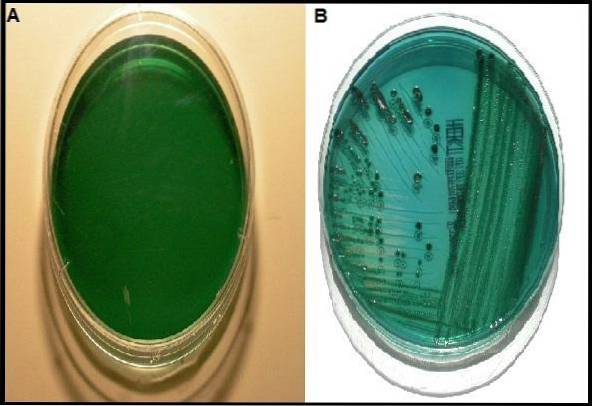
Obwohl es andere Medien mit der gleichen Funktion wie Hektoen-Agar gibt, hat es im Vergleich zu anderen Medien einen größeren Vorteil, insbesondere wenn Sie Shigella-Arten wiederherstellen möchten..
Die Arten beider Geschlechter verursachen beim Menschen aufgrund des Verzehrs kontaminierter Lebensmittel schwere Magen-Darm-Probleme. Daher ist die Übertragung fäkal - oral. Aus diesem Grund ist die Verwendung von Hektoen-Agar hauptsächlich bei der mikrobiologischen Analyse von Stuhl- und Lebensmittelproben angezeigt..
Artikelverzeichnis
- 1 Begründung
- 2 Vorbereitung
- 3 Verwenden Sie
- 4 Qualitätskontrolle
- 5 Einschränkungen
- 6 Referenzen
Basis
Hektoen-Agar enthält Peptonen und Hefeextrakt als Nährstoffquelle und liefert die wesentlichen Elemente für die mikrobielle Entwicklung.
Es hat jedoch auch Gallensalze, die das Wachstum einiger Bakterien hemmen, insbesondere grampositive und einige gramnegative. Aus diesem Grund wird es als selektives Medium angesehen.
Hektoen-Agar ist dagegen ein Differenzialmedium. Diese Eigenschaft wird durch die Anwesenheit von fermentierbaren Kohlenhydraten wie Lactose, Saccharose und Salicin zusammen mit dem pH-Indikatorsystem, dargestellt durch Bromthymolblau und saures Fuchsin, verliehen..
Alle Bakterien, die auf diesem Medium wachsen können und nicht zur Gattung Salmonella und Shigella gehören, entwickeln mit Ausnahme der Gattung Proteus Lachs- oder Orangenkolonien. Dies ist auf die Fermentation eines oder mehrerer der vorhandenen Kohlenhydrate zurückzuführen, die das Medium ansäuert, wodurch sich der pH-Indikator ändert..
Die Gattungen Shigella und Salmonella sind ihrerseits nicht in der Lage, die vorhandenen Kohlenhydrate zu fermentieren, wobei nur Peptonen als Energiequelle verwendet werden, die das Medium alkalisieren und daher ihre Kolonien blaugrün sind.
In diesem Medium können auch Bakterien unterschieden werden, die Schwefelwasserstoff (farbloses Gas) bilden können. Natriumthiosulfat wirkt als Schwefelquelle, während Eisencitrat das Entwicklungsmittel ist. Beide Verbindungen ermöglichen die Bildung eines schwarzen Eisensulfidniederschlags, der die Reaktion zeigt.
Der schwarze Niederschlag in der Mitte der Kolonie mit einem transparenten Lichthof umgibt ein Fischaugen-Erscheinungsbild. Dieses Merkmal deutet auf das Vorhandensein der Gattung Salmonella hin.
Schließlich hält das Natriumchlorid das osmotische Gleichgewicht aufrecht und der Agar verleiht dem Medium die feste Konsistenz..
Vorbereitung
76 g des dehydrierten Mediums werden gewogen und in einem Liter destilliertem Wasser gelöst. Schütteln Sie die Mischung kräftig und lassen Sie sie dann 10 bis 15 Minuten ruhen. Es kann erhitzt und gekocht werden, wobei Drehbewegungen bis zu seiner vollständigen Auflösung ausgeführt werden. Dieses Medium wird nicht autoklaviert.
Wenn das Medium eine Temperatur von ungefähr 45 ° C erreicht, gießen Sie ein Volumen von 20 ml direkt in sterile Petrischalen..
Der Agar darf sich verfestigen. Zu diesem Zeitpunkt sind sie einsatzbereit. Es wird empfohlen, sie sofort zu verwenden. Ist dies nicht möglich, werden sie bis zur Verwendung im Kühlschrank aufbewahrt..
Die Platten sollten vor dem Säen aus dem Kühlschrank genommen werden, um sie auf Raumtemperatur zu bringen.
Der pH-Wert des Mediums sollte 7,5 ± 0,2 betragen. Die Farbe des dehydrierten Mediums ist lila und das vorbereitete Medium ist bräunlichgrün.
Benutzen
Die Verwendung von Hektoen-Agar wird empfohlen, um in Stuhl- und Lebensmittelproben nach Bakterien der Gattungen Shigella und Salmonella zu suchen..
Die Möglichkeit, diese Bakterien zu isolieren, ist erheblich erhöht, wenn die Probe zuvor mit speziellen Brühen wie Selenitbrühe, Cystinselenitbrühe, Tetrathionatbrühe usw. angereichert wurde..
Das Inokulum muss stark sein und die Aussaat erfolgt durch Streifenbildung. Die Platten werden 24 bis 48 Stunden bei 37 ° C in Aerobiose inkubiert.
Eine Inkubation von 48 Stunden wird empfohlen, da die Eigenschaften der Kolonien zu diesem Zeitpunkt für ihre Interpretation und Differenzierung klarer sind..
QA
Zur Qualitätskontrolle dieses Mediums werden zertifizierte Bakterienstämme verwendet, wie z. Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Shigella flexneri ATCC 12022 und Shigella sonnei ATCC 25931.
Die erwarteten Ergebnisse sind wie folgt: Salmonella typhimurium und Salmonella enteritidis Sie sollten blaugrüne Kolonien mit oder ohne schwarzem Zentrum entwickeln. Während die Shigella-Arten als grün-bläuliche Kolonien wachsen.
Stämme von Escherichia coli ATCC 29212, Proteus mirabilis, Klebsiella pneumoniae ATCC 700603, Enterococcus faecalis ATCC 29212 und Staphylococcus aureus ATCC 25923.
In diesen Fällen sind die beobachteten Merkmale die folgenden: E coli Y. K. pneumoniae Kolonien entwickeln sich in dieser mittleren Lachsfarbe zu Orange mit einem Niederschlag der gleichen Farbe. Während Proteus blaugrüne Kolonien mit oder ohne schwarzem Zentrum entwickeln wird..
Während S. aureus Y. E. faecalis muss manchmal gehemmt werden E. faecalis schafft es, als sehr kleine, gelbe Kolonien zu wachsen.
Andererseits ist es wichtig, die Sterilität des Mediums zu bewerten, da dieses Medium nicht autoklaviert wird. Daher sollten von jeder hergestellten Charge ein bis zwei nicht inokulierte Platten 24 Stunden bei 37 ° C in Aerobiose inkubiert werden..
Offensichtlich wird auf der Platte keinerlei Wachstum erwartet.
Einschränkungen
-Proteus-Arten können sich in diesem Medium entwickeln und die Eigenschaften ihrer Kolonien können mit Salmonella- oder Shigella-Arten verwechselt werden. Aus diesem Grund muss jede verdächtige Kolonie durch biochemische Tests bestätigt werden..
-Es ist notwendig, die Verwendung dieses Mediums mit anderen weniger selektiven Agaren zu begleiten, denn wenn der gesuchte Mikroorganismus in geringen Konzentrationen gefunden wird, kann er sich in diesem Medium möglicherweise nicht entwickeln..
-Während der Zubereitung nicht überhitzen, da übermäßige Hitze die Zusammensetzung des Mediums verändert.
-Laktosefermentierende Salmonellenkolonien können ungewöhnlich erscheinen und unbemerkt bleiben.
Verweise
- Wikipedia-Mitwirkende. Hektoen enterischer Agar. Wikipedia, die freie Enzyklopädie. 13. März 2019, 23:38 UTC. Verfügbar unter: .wikipedia.org / Zugriff am 16. März 2019.
- BD Laboratories. BD Hektoen Enterischer Agar (HE Agar). 2013. Verfügbar unter: bd.com
- Britannia Laboratories. Hektoen Enteric Agar. 2015. Verfügbar unter: britanialab.com
- Difco Francisco Soria Melguizo Laboratories. Hektoen Agar. Verfügbar unter: f-soria.es
- Difco & BBL Handbuch, Hektoen Enteric Agar. 2. Auflage. Verfügbar in: bd.com/europe


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.