
Grundierung, Zubereitung und Verwendung von Maismehlagar

Das Maismehlagar ist ein festes Kulturmedium mit geringer Nährleistung, das zur Subkultivierung bestimmter Pilze und zum Nachweis von Chlamydosporen in Stämmen des Komplexes nützlich ist Candida albicans. Auf Englisch ist es als Maismehlagar bekannt.
Das herkömmliche Maismehlmedium hat eine sehr einfache Zusammensetzung, es enthält Maismehl, Agar-Agar und Wasser. Aufgrund seines geringen Nährstoffgehalts eignet es sich ideal zur Erhaltung von Pilzstämmen über einen längeren Zeitraum, insbesondere von schwarzen Pilzen..
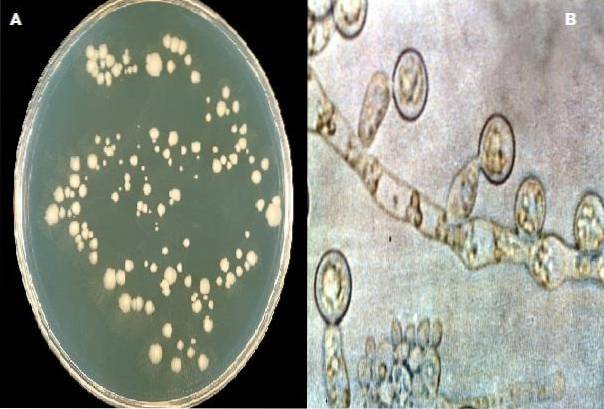
Sporulation des Komplexes Candida albicans In diesem Medium wird es bevorzugt, wenn während der Herstellung des Agars 1% Tween 80 zugesetzt wird. Die Bildung von Chlamydosporen ist charakteristisch für diese Art und praktisch die einzige, die den Menschen betrifft..
Es gibt andere Arten, die Chlamydosporen bilden, aber es ist unwahrscheinlich, dass sie Menschen betreffen, wie z Candida australis, vorhanden in Pinguinkot oder C. clausenii, Das ist ein selten gefundener Saprophyt. Ebenso ausnahmsweise die Art C. stellatoidea Y. C. tropicalis könnte sie bilden.
Andererseits begünstigt die Zugabe von Glucose zum Maismehlmedium die Bildung von Pigmenten in Stämmen von Trichophytom rubrum.
Es ist wichtig zu beachten, dass es Pilze gibt, die in Maismehlagar keine Hyphen oder Pseudohyphen bilden, wie z Cryptococcus neoformans, Differenzierung von anderen Genres.
Maismehlagar kann im Labor hausgemacht sein oder es können auch kommerzielle Medien verwendet werden..
Artikelverzeichnis
- 1 Begründung
- 2 Vorbereitung
- 2.1 Handelsüblicher Maismehlagar
- 2.2 Maismehlagar mit Tween 80
- 2.3 Maismehlagar mit Glukose
- 3 Verwenden Sie
- 3.1 Aussaat
- 3.2 Nachweis von Chlamydosporen
- 3.3 Erhaltung von Pilzstämmen
- 4 Qualitätskontrolle
- 5 Einschränkungen
- 6 Referenzen
Basis
Maismehl ist das Substrat, Agar ist das Verfestigungsmittel und Wasser ist das Lösungsmittel..
Maismehlagar kann mit Tween 80 (Sorbitanmonooleat oder Polysorbatpolyester 80) ergänzt werden. Diese Verbindung verringert die Oberflächenspannung des Mediums aufgrund seiner Emulgierkraft.
Es schafft auch eine feindliche Umgebung, die eine übertriebene Zellvermehrung hemmt und das Wachstum von Hyphen stimuliert, wodurch auch die Produktion von Chlamydosporen begünstigt wird. Letztere betrachteten Widerstandsstrukturen. Diese Struktur hilft bei der Identifizierung der Arten von Candida albicans.
Glucose in diesem Medium erhöht seinerseits die Pigmentbildungskapazität einiger Pilze..
Es ist zu beachten, dass das Maismehl mit mittlerer Glucose nicht dazu dient, Chlamydosporen in c nachzuweisenCandida albicans-Komplex.
Vorbereitung
Hausgemachte Maismehl-Agar-Zubereitung
47 g gelbes Maismehl abwiegen und in 500 ml destilliertem Wasser auflösen. Auf 60 ºC erhitzen und die Zubereitung etwa 1 Stunde lang umrühren. Filtrieren Sie dann durch ein Stück Gaze und Baumwolle. Optional kann es erneut filtriert werden, indem Sie das Präparat durch ein Whatman Nr. 2-Filterpapier führen.
Füllen Sie das Volumen mit destilliertem Wasser auf 1000 ml auf. Fügen Sie 17 g Agar-Agar hinzu und erhitzen Sie es, bis es sich aufgelöst hat. 15 Minuten bei 121 ºC autoklavieren.
In sterilen Petrischalen servieren. Im Kühlschrank aufbewahren.
Die Farbe des vorbereiteten Mediums ist weißlich mit einem klumpigen Aussehen.
Wenn Sie Maismehl mit Glukose zu der oben beschriebenen Zubereitung zubereiten möchten, fügen Sie 10 g Glukose hinzu.
Kommerzieller Maismehlagar
17 g des dehydrierten Mediums werden gewogen und in 1 Liter destilliertem Wasser gelöst. Die Mischung kann unter leichtem Schütteln erhitzt werden, um sich vollständig aufzulösen. Sterilisieren Sie in einem Autoklaven bei 121 ºC bei 15 lb für 15 Minuten.
In sterile Petrischalen gießen. Erstarren lassen. Umdrehen und bis zur Verwendung im Kühlschrank aufbewahren. Vor Gebrauch temperieren.
Der pH-Wert sollte bei 25 ºC 6,0 ± 0,2 betragen.
Maismehlagar mit Tween 80
Um der ISO 18416 zu entsprechen, muss Maismehlagar wie folgt hergestellt werden:
Wiegen Sie 65 Gramm pro Liter und geben Sie 10 ml Tween 80 hinzu. Erhitzen und kochen Sie einige Minuten, bis sich alles aufgelöst hat. Achten Sie dabei darauf, dass Sie nicht zu stark überhitzen. 15 Minuten bei 121 ºC sterilisieren.
Maismehlagar mit Glukose
Zur Steigerung der chromogenen Kraft von Kolonien von Trichophyton rubrum und unterscheiden sie von T. mentagrophytes, Der ursprünglichen Formel können 0,2% Glucose zugesetzt werden. Tween 80 ist nicht erforderlich, da Glukose die Bildung von Chlamydosporen hemmt.
Benutzen
Die Verwendung von Maismehlagar ist hauptsächlich für die Untersuchung von Candida-Stämmen vorgesehen, um deren Identifizierung durch die charakteristische Beobachtung von Chlamydosporen bei Albicans-Arten zu erleichtern. Das heißt, die Verwendung dieses Agars dient als Hilfsmethode zur Identifizierung dieser Hefen..
Auf diesem Agar können sich sowohl saprophytische als auch pathogene Spezies entwickeln, die jedoch jeweils charakteristische Myzelstrukturen bilden. Beispielsweise produzieren Arten der Gattung Torulopsis kein Myzel und vermehren sich nur durch Blastokonidien..
Ebenso produzieren die Trichosporon- und Geotrichum-Arten Arthrokonidien auf Maismehlagar, und es ist manchmal schwierig, zwischen den beiden zu unterscheiden..
Arthrokonidien der Gattung Geotrichum erzeugen eine Erweiterung der Hyphen, die einem Hockeyschläger ähnelt..
Auch die Herstellung von Pigmenten unter Verwendung von mit Glucose ergänztem Maismehlagar ist bei der Identifizierung von nützlich Trichophytom rubrum.
Gesät
Verdächtige Candida-Kolonien, die im primären Kulturmedium - Sabouraud-Agar - unter anderem aus klinischen Proben, Kosmetika und Böden gewonnen wurden, werden auf Maismehlagar subkultiviert. Das Medium wird ausgesät und 24 bis 48 Stunden bei 22 ° C inkubiert. Die Inkubationszeit kann bei Bedarf verlängert werden.
Chlamydospore-Demonstration
Zu diesem Zweck muss der Maismehlagar mit Tween 80 mit der Dalmau-Technik beimpft werden. Diese Methode besteht darin, einen Teil der vermuteten Kolonie mit dem Platingriff zu nehmen und drei parallele Schnitte in der Mitte durchzuführen, wobei der Griff bei 45 ° gehalten wird. Die Schnitte müssen einen Abstand von 1 cm voneinander haben.
Anschließend wird ein zuvor geflammtes Deckobjekt auf die gesäten Streifen gelegt, so dass die Hälfte bedeckt und die andere freigelegt wird.
Inkubieren Sie die ausgesäten Platten 48-72 Stunden bei 30 ° C und untersuchen Sie sie dann mikroskopisch durch das Deckglas..
Erhaltung von Pilzstämmen
Zur Aufrechterhaltung der Stämme werden die ausgesäten und gewachsenen Platten im Kühlschrank (4 bis 8 ºC) gelagert. Auf diese Weise können sie mehrere Wochen dauern und für Lehr- oder Forschungszwecke verwendet werden..
QA
Für die Sterilitätskontrolle wird eine Platte ohne Inokulation bei Raumtemperatur inkubiert, es wird erwartet, dass es kein Wachstum oder keine Farbänderung gibt.
Zur Qualitätskontrolle sind bekannte Stämme wie: Staphylococcus aureus, ATCC 6538, Escherichia coli ATCC 25922, Aspergillus niger ATCC 16404, Candida albicans ATCC 1023, Saccharomyces cerevisiae ATCC 9763.
Die erwarteten Ergebnisse sind teilweise Hemmung für S. aureus Y. E coli. Während für die übrigen Stämme ein zufriedenstellendes Wachstum erwartet wird.
Aspergillus niger wächst mit schwarzen und sporulierten Kolonien in einer ungefähren Zeit von 5 Tagen Inkubation.
Candida albicans Hefekolonien mit Chlamydosporenproduktion.
Saccharomyces cerevisiae produzieren große Hefezellen.
Einschränkungen
Am Boden der Platte bildet sich ein gelber Niederschlag, der nicht mit Kolonien verwechselt werden darf..
Verweise
- Neogen Laboratories. Maismehl-Agar. Verfügbar unter: Foodsafety.neogen.com.
- Kulturmedien-Microkit. Maismehl-Agar. Verfügbar unter: Medioscultivo.com.
- Linares M, Solís F. Handbuch zur Identifizierung von Hefen. Verfügbar unter: http: //www.guia.revibero.
- Urcia F, Guevara M. Rev. Perú Med.Exp. Öffentliche Gesundheit, 2002; 19 (4): 206 & ndash; 208. Verfügbar unter: Scielo.com
- Casas-Rincón G. Allgemeine Mykologie. 1994. 2. Aufl. Central University of Venezuela, Library Editions. Venezuela Caracas.
- Forbes B., Sahm D., Weissfeld A. (2009). Bailey & Scott Mikrobiologische Diagnose. 12 ed. Editorial Panamericana S.A. Argentinien.
- Koneman E., Allen S., Janda W., Schreckenberger P., Winn W. (2004). Mikrobiologische Diagnose. 5. Aufl. Editorial Panamericana S.A. Argentinien.
- Castillo E. Vergleichende Untersuchung einiger makro- und mikroskopischer Methoden zur Isolierung und Erkennung der Gattung Candida. Kolumbianische Rev. of Pharmaceutical Chemical Sciences. 1970; 3 (1): 33-57. Verfügbar unter: Ciencias.unal.edu.co

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.