
Baird Parker Agar Foundation, Vorbereitung und Verwendung
Das Baird Parker Agar Es ist ein festes, selektives und differenzielles Kulturmedium. Es wurde 1962 zum Nachweis und zur Zählung von Koagulase-positiven Staphylokokken (Staphylococcus aureus).
Es besteht aus Pankreas-Caseinhydrolysat, Fleischextrakt, Hefeextrakt, Lithiumchlorid, Glycin, Natriumpyruvat, Kaliumtellurit, Agar und Eigelbemulsion..
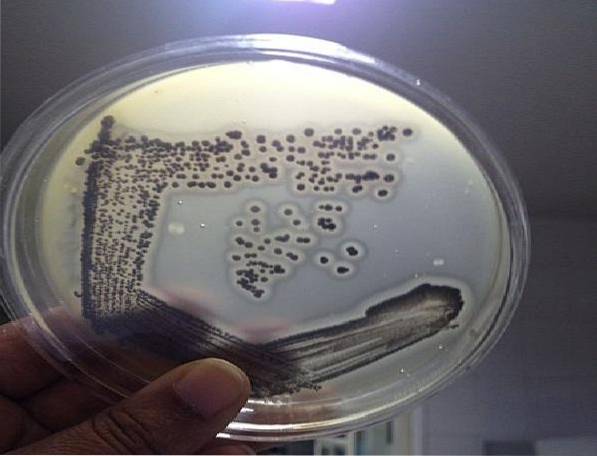
Baird Parker Agar basiert auf der Fähigkeit des S. aureus Tellurit zu reduzieren und Lecithinase zu produzieren. Beide Eigenschaften erzeugen eine Kolonie mit spezifischen Eigenschaften für diese Art. Daher ist es beim Nachweis dieses Mikroorganismus hochwirksam..
Die typischen Kolonien von S. aureus Sie sind schwarz oder dunkelgrau, mit einem farblosen Rand und einem hellen Lichthof, der sie umgibt und sie von anderen Mikroorganismen unterscheidet. Dieser Erreger kann in klinischen Proben, Gewässern, Kosmetika sowie rohen oder gekochten Lebensmitteln gefunden werden..
Die Diagnose oder Erkennung ist von größter Bedeutung, da sie verschiedene Pathologien hervorruft, darunter Lebensmittelvergiftungen, Verbrühungssyndrom, Toxic-Shock-Syndrom, Abszesse, Meningitis, Septikämie und Endokarditis..
Artikelverzeichnis
- 1 Begründung
- 1.1 Nährkraft
- 1.2 Selektiv
- 1.3 Differential
- 2 Vorbereitung
- 2.1 Eigelbemulsion
- 2.2 Kaliumtellurit 1% w / v
- 2.3 Herstellung des Kulturmediums
- 3 Verwenden Sie
- 3.1 Klinische Proben
- 3.2 Lebensmittelproben
- 3.3 Wasserproben
- 4 Qualitätskontrolle
- 5 Empfehlungen
- 6 Referenzen
Basis
Nährende Kraft
Pankreas-Kaseinhydrolysat, Fleischextrakt und Hefeextrakt sind die Quellen für Nährstoffe, Vitamine und Mineralien, die für die allgemeine mikrobielle Entwicklung notwendig sind, während Pyruvat und Glycin Verbindungen sind, die das spezifische Wachstum von fördern Staphylococcus aureus.
Selektiv
Baird Parker Agar ist selektiv, weil es Substanzen enthält, die das Wachstum der begleitenden Flora hemmen und gleichzeitig die Entwicklung von fördern S. aureus. Die inhibitorischen Verbindungen sind Lithiumchlorid und Kaliumtellurit..
Differential
Dieses Medium ermöglicht eine Differenzierung S. aureus vom Rest der Koagulase-negativen Staphylokokken. S. aureus hat die Fähigkeit, Tellurit zu freiem metallischem schwarzem Tellur zu reduzieren und schwarze oder dunkelgraue Kolonien zu bilden.
Ebenso liefert das Eigelb die Substrate, um das Vorhandensein des Enzyms Lecithinase und Lipase nachzuweisen.. S. aureus ist Lecithinase-positiv und daher wird ein klarer Lichthof um die Kolonie beobachtet, was darauf hinweist, dass das Lecithin hydrolysiert wurde.
In diesem Sinne zeigt das Auftreten von glänzenden schwarzen oder dunkelgrauen Kolonien auf diesem Agar mit einem hellen Lichthof um sie herum das Vorhandensein von S. aureus.
Wenn sich eine Fällungszone bildet, zeigt dies die Lipaseaktivität an. Einige Stämme von S. aureus Sie sind Lipase positiv und andere negativ.
Für den Fall, dass die S. aureus Wenn die Lipase positiv ist, wird ein undurchsichtiger Bereich um die schwarze oder dunkelgraue Kolonie und dann ein heller Lichthof aufgrund der Wirkung von Lecithinase beobachtet.
Andere Bakterienkolonien als S. aureus In diesem Medium wachsen können farblose oder braune Kolonien ohne umgebenden Lichthof.
Atypische schwarze Kolonien können auch mit oder ohne farblosen Rand gesehen werden, jedoch ohne hellen Lichthof. Diese Kolonien sollten nicht berücksichtigt werden, sie entsprechen nicht S. aureus.
Vorbereitung
Eigelbemulsion
Nehmen Sie ein frisches Hühnerei, waschen Sie es gut und legen Sie es 2 bis 3 Stunden lang in 70% igen Alkohol. Das Ei wird dann aseptisch geöffnet und das Weiß vorsichtig vom Eigelb getrennt. Anschließend werden 50 ml des Eigelbs entnommen und mit 50 ml steriler physiologischer Lösung gemischt..
Kaliumtellurit 1% w / v
Einige Handelshäuser verkaufen 1% Kaliumtellurit gebrauchsfertig. Es wird dem Medium zugesetzt, bevor sich das Medium verfestigt.
Zur Herstellung dieser Lösung im Labor werden 1,0 g Kaliumtellurit gewogen und in einem Teil Wasser gelöst. Anschließend wird die Wassermenge bis zum Erreichen von 100 ml vervollständigt. Die Lösung muss durch die Filtrationsmethode sterilisiert werden.
Vorbereitung des Kulturmediums
60 g des dehydrierten Mediums werden abgewogen und in 940 ml destilliertem Wasser gelöst. Lassen Sie die Mischung ca. 5 bis 10 Minuten ruhen.
Wenden Sie Wärme an, indem Sie das Medium häufig umrühren, um den Auflösungsprozess zu verbessern. Für eine Minute zum Kochen bringen. Im Autoklaven 15 Minuten bei 121 ° C sterilisieren.
Stehen lassen, bis eine Temperatur von 45 ° C erreicht ist, und 50 ml der Eigelbemulsion und 10 ml 1% Tellurit hinzufügen. Gut mischen und 15-20 ml auf sterile Petrischalen gießen..
Erstarren lassen, umgedreht in Knopfleisten anordnen und bis zur Verwendung im Kühlschrank aufbewahren.
Der endgültige pH-Wert des hergestellten Mediums muss 6,8 ± 0,2 betragen.
Warten Sie vor dem Aussäen einer Probe, bis die Platte Raumtemperatur erreicht hat. Säen Sie die Teller durch Streifen oder Oberflächenaussaat mit einem Drigalski-Spatel.
Die Farbe des dehydrierten Mediums ist hellbraun und die Farbe des hergestellten Mediums ist hell bernsteinfarben.
Benutzen
Klinische Proben
Die klinischen Proben werden direkt ausgesät, indem ein Teil des Materials an einem Ende der Platte abgelassen wird, und von dort wird es durch Erschöpfung gestreift. 24 bis 48 Stunden bei 35-37 ° C inkubieren.
Lebensmittelproben
10 g der Lebensmittelprobe werden gewogen und in 90 ml 0,1% igem Peptonwasser homogenisiert. Daraus werden gegebenenfalls Verdünnungen hergestellt. Inokulieren Sie die Platten dreifach mit 0,3 ml der hergestellten Lösungen und säen Sie sie mit einem Drigalski-Spatel auf die Oberfläche. 24 bis 48 Stunden bei 35-37 ° C inkubieren.
Diese Methode ermöglicht es, die typischen erhaltenen Kolonien zu zählen und ist ideal, wenn das Vorhandensein von S. aureus über 10 KBE pro g / ml Probe.
Wenn die Menge von S. aureus Es ist klein oder es gibt viel begleitende Flora. Es wird empfohlen, die Probe in Trypticase-Soja-Brühe mit 10% NaCl und 1% Natriumpyruvat anzureichern. Dies wird das Wachstum von begünstigen S. aureus und hemmt die Entwicklung der begleitenden Flora. Trübe Röhrchen werden auf Baird Parker-Agar ausgesät..
Wasserproben
In einem sterilisierten Vakuumfiltrationssystem werden 100 ml Studienwasser filtriert, und anschließend wird die mikroporöse Membran von 0,4 Mikron mit einer sterilen Pinzette entfernt und auf eine Baird Parker-Platte gelegt. 24 bis 48 Stunden bei 35-37 ° C inkubieren. Diese Technik ermöglicht das Zählen typischer Kolonien von S. aureus.
QA
Bekannte Stämme können verwendet werden, um die Qualität von Baird Parker Agar zu bewerten, wie z Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis ATCC 12228, Escherichia coli ATCC 25922 oder Proteus mirabilis ATCC 43071.
Bei Stämmen von S. aureus Es ist bekannt, dass ATCC Tellurit reduziert, und sie sind Lipase- und Lecithinase-positiv. Daher muss es eine zufriedenstellende Entwicklung geben und konvexe Kolonien mit einem schwarzen Zentrum und einem farblosen Rand mit einem undurchsichtigen Lichthof und einem hellen äußersten Lichthof wachsen..
Für seinen Teil, S. epidermidis Auf diesem Medium wird eine schlechte Entwicklung mit bräunlich-grauen bis schwarzen Kolonien ohne hellen Lichthof erwartet.
Damit E coli Y. P. mirabilis Es wird erwartet, dass es ganz oder teilweise gehemmt wird. Im Falle eines Wachstums entwickeln sich braune Kolonien ohne undurchsichtigen Bereich oder hellen Lichthof.
Empfehlungen
-Das Medium sollte nach Zugabe von Tellurit und Eigelb nicht erhitzt werden.
-Die Herstellung der Eigelbemulsion und ihre Zugabe in der Mitte ist ein sehr anfälliger Schritt für eine Kontamination. Es muss aufgepasst werden.
-Wenn es typische Kolonien von gibt S. aureus muss durch Anbringen eines Koagulase-Tests an diesem Stamm bestätigt werden.
-Bei zweifelhaften Ergebnissen mit Koagulase sollten andere Bestätigungstests durchgeführt werden.
-Achten Sie darauf, das Vorhandensein typischer Kolonien von nicht zu verwechseln S. aureus mit atypischen schwarzen Kolonien.
Verweise
- Wikipedia-Mitwirkende. Baird-Parker-Agar. Wikipedia, die freie Enzyklopädie. 15. März 2017, 19:36 UTC. Verfügbar unter: wikipedia.org/ Zugriff am 18. Februar 2019.
- BD Laboratories. Baird Parker Agar. 2006. Verfügbar unter: bd.com
- Britannia Laboratories. Baird Parker Agar Base. 2015. Verfügbar unter: britanialab.com
- Francisco Soria Melguizo Laboratories. 2009. Baird Parker Agar. Verfügbar unter: http://f-soria.es/Inform
- Britannia Laboratories. Kaliumtellurit. 2015. Verfügbar unter: britanialab.com
- Alarcón-Lavín M., Oyarzo C., Escudero C., Cerda-Leal F., Valenzuela F. Tragen von Staphylococcus aureus enterotoxigener Typ A in Nasopharynxabstrichen bei Lebensmittelhändlern. Rev Med Chile 2017; 145: 1559 & ndash; 1564
- Venezolanischer Standard Covenin 1292-89. (1989). Essen. Isolierung und Zählung Staphylococcus aureus. Verfügbar in:sencamer.gob.ve

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.