
Acinetobacter baumannii Eigenschaften, Morphologie, Symptome
Acinetobacter baumannii Es ist ein gramnegatives Bakterium, das zur Ordnung der Pseudomonas gehört. Während seiner taxonomischen Geschichte war es in den Gattungen angesiedelt Mikrokokken, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea Y. Achromobacter, bis es 1968 in sein aktuelles Genre aufgenommen wurde.
ZU. baumannii Es ist ein pathogenes Bakterium, das als die Art angesehen wird, die am häufigsten an Infektionen innerhalb seiner Gattung beteiligt ist. Es wurde festgestellt, dass es an verschiedenen Arten von Infektionen wie Septikämie, Lungenentzündung und Meningitis beteiligt ist.
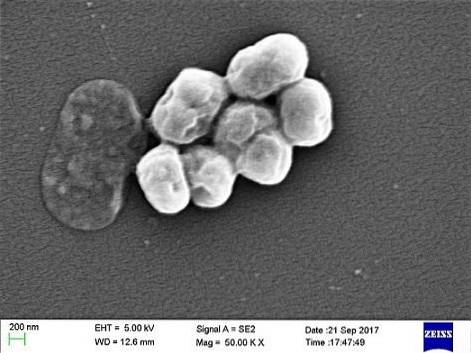
Es ist ein opportunistischer Parasit, der eine signifikante Inzidenz bei Krankenhaus- oder nosokomialen Erkrankungen aufweist. Die Übertragung durch mechanische Beatmung wurde als wichtige Ansteckungsursache identifiziert, insbesondere auf Intensivstationen.
Obwohl es als minderwertiger Erreger angesehen wird, kann es seine Virulenz bei Stämmen erhöhen, die an häufigen Infektionen beteiligt sind. Es hat eine große Fähigkeit, Resistenzen und Multiresistenzen gegen Antibiotika zu entwickeln.
In Krankenhäusern wird es hauptsächlich durch den Kontakt des Personals, durch die Verwendung von kontaminiertem Krankenhausmaterial und auch über die Luft über kurze Strecken übertragen.
Die Weltgesundheitsorganisation umfasst A. baumannii auf einer Liste resistenter Krankheitserreger, für die dringend neue Antibiotika benötigt werden, mit der Kategorie 1 mit kritischer Priorität.
Artikelverzeichnis
- 1 Eigenschaften von Acinetobacter baumannii
- 2 Morphologie
- 3 Stoffwechsel
- 4 Antibiotikaresistenz
- 5 Pathologien
- 6 Symptome
- 7 Behandlung
- 8 Referenzen
Eigenschaften von Acinetobacter baumannii
Alle Arten der Gattung Acinetobacter haben eine breite Verbreitung in verschiedenen natürlichen Nischen. A. baumannii Es kann auf natürliche Weise die Haut gesunder Menschen bewohnen und Schleimhautoberflächen besiedeln, die ein wichtiges epidemiologisches Reservoir darstellen. Der Lebensraum von A. baumannii ist fast ausschließlich in Krankenhausumgebungen.
Diesen Bakterien fehlen Flagellen oder Strukturen, die zur Fortbewegung verwendet werden. Sie erreichen jedoch Bewegung durch Strukturen, die es ihnen ermöglichen, sich auszudehnen und zurückzuziehen, und durch chemische Mechanismen wie die Ausscheidung eines Films eines Exopolysaccharids mit hohem Molekulargewicht hinter den Bakterien..
A. baumannii kann eine große Anzahl lebender oder inerter Umgebungen besiedeln und hat eine große Fähigkeit, über einen längeren Zeitraum auf künstlichen Oberflächen zu überleben.
Diese Fähigkeit beruht möglicherweise auf ihrer Fähigkeit, Dehydration zu widerstehen, verschiedene Kohlenstoffquellen über verschiedene Stoffwechselwege zu nutzen und auf der Fähigkeit, Biofilme zu bilden. Aus diesem Grund ist es üblich, es in Krankenhausmaterial wie Kathetern und mechanischen Beatmungsgeräten zu finden..
Morphologie
A. baumannii ist ein Coccobacillus mit einer Zwischenform zwischen Kokken und Stäbchen. Sie messen 1,5 bis 2,5 mal 1 bis 1,5 Mikrometer, wenn sich die Populationen in einer logarithmischen Wachstumsphase befinden. Sie sind kugelförmiger, wenn sie die stationäre Phase erreichen.
Stoffwechsel
Die Bakterien A. baumannii es ist kein Glukosefermenter; es ist streng aerob, das heißt, es benötigt Sauerstoff für seinen Stoffwechsel.
Die Art der Gattung Acinetobacter Sie sind die einzigen aus der Familie der Moraxellaceae, denen Cytochrom-C-Oxidasen fehlen, für die sie in Oxidasetests negative Ergebnisse liefern.
A. baumannii wächst bei Temperaturen zwischen 20 und 44 ° C, wobei die optimale Temperatur zwischen 30 und 35 ° C liegt.
Antibiotika Resistenz
Die ständige Entstehung von Antibiotikaresistenzen behindert nicht nur die Behandlung und Kontrolle von Infektionen durch A. baumannii, Es fördert auch die Auswahl endemischer und epidemischer multiresistenter Stämme.
Einige intrinsische Mechanismen von A. baumannii, die Antibiotikaresistenz fördern:
- Das Vorhandensein von β-Lactamasen verleihen Resistenz gegen b-Lactame.
- Die Produktion spezifischer Enzyme wie Ammoniglucosid-3'-phosphotransferase VI inaktiviert Amikacin.
- Das Vorhandensein von Oxacillinase OXA-51 hydrolysiert Penicilline und Carbapeneme.
- Das Vorhandensein und die Überexpression von Refluxpumpen, bei denen es sich um Pumpen handelt, die kleine Moleküle aus der Zelle ausstoßen, die es schaffen, in das Zytoplasma einzudringen, wodurch ihre Anfälligkeit für Antibiotika verringert wird.
Die Biofilme von A. baumannii den Stoffwechsel von Mikroorganismen verändern, ihre Empfindlichkeit gegenüber Antibiotika verringern, eine physikalische Barriere gegen große Moleküle bilden und die Dehydration von Bakterien verhindern.
Pathologien
A. baumannii kolonisiert einen neuen Wirt durch Kontakt mit infizierten Personen oder mit kontaminierten medizinischen Geräten. Dieses Bakterium bindet sich zunächst an die Haut- und Schleimhautoberflächen. Um sich zu vermehren, muss es Antibiotika und Inhibitoren sowie die Bedingungen dieser Oberflächen überleben..
Die Zunahme der Anzahl von Bakterien auf Schleimhautoberflächen, insbesondere unter Krankenhausbedingungen bei Kontakt mit intravaskulären Kathetern oder Endotrachealtuben, kann das Risiko einer Infektion der Atemwege und des Blutkreislaufs erhöhen..
Eine im Krankenhaus erworbene Lungenentzündung ist die häufigste Infektion, die durch verursacht wird A. baumanii. Wird häufig auf Intensivstationen von Patienten mit mechanisch unterstützter Beatmung unter Vertrag genommen.
A. baumanii Es hat auch große Infektionsprobleme bei Militärpersonal mit Nachkriegstrauma verursacht, insbesondere im Irak und in Afghanistan. Insbesondere aufgrund von Osteomyelitis und Weichteilinfektionen, die Nekrose und Cellulitis verursachen können.
Es besteht auch das Risiko einer Meningitis ab A. baumanii bei Patienten, die sich von der Neurochirurgie erholen.
Personen, die anfällig für Infektionen sind durch A. baumanii Dazu gehören diejenigen, die zuvor auf Intensivstationen Antibiotika, größere Operationen, Verbrennungen, Traumata, Immunsuppression oder invasive medizinische Geräte, hauptsächlich mechanische Beatmung, eingesetzt haben.
Symptome
Es gibt keine spezifische Symptomatik von Infektionen durch A. baumanii. Jede der verschiedenen Infektionen, die durch dieses Bakterium hervorgerufen werden, hat ihre eigenen charakteristischen Symptome..
Im Allgemeinen die Symptome von Infektionen, die beteiligt sein können A. baumanii oder andere opportunistische Bakterien wie Klebsiella pneumoniae Y. Streptococcus pneumoniae, Dies kann Fieber, Schüttelfrost, Hautausschlag, schmerzhaftes Wasserlassen, häufiges Urinieren, Verwirrtheit oder veränderte psychische Zustände, Übelkeit, Muskelschmerzen, Brustschmerzen und Husten umfassen.
Behandlung
Antibiotika zur Behandlung von Infektionen durch A. baumannii Sie sind aufgrund ihrer großen Fähigkeit, Widerstände und Mehrfachwiderstände zu erfassen, äußerst begrenzt. Aus diesem Grund ist es wichtig, die Empfindlichkeit jedes Stammes gegenüber verschiedenen Antibiotika zu bestimmen, um die Wirksamkeit jeder Behandlung zu gewährleisten..
Angesichts der Resistenz gegen Carbapeneme wurde trotz eines relativ niedrigen Resistenzindex und seiner Nebenwirkungen auf die Nieren auf die Verwendung von Polymyxinen, insbesondere Colistin, zurückgegriffen.
Colistin-resistente Stämme wurden jedoch bereits nachgewiesen. Als Alternative zur Resistenz gegen diese Antibiotika wurde eine Kombinationstherapie eingesetzt.
Verweise
- Bergogne-Bérézin, E. & Towner, K.J.. Acinetobacter spp. als nosokomiale Krankheitserreger: mikrobiologische, klinische und epidemiologische Merkmale. Clin Microbiol Rev. 9 (1996), pp. 148-165.
- Fournier, P. E., Richet, H. (2006). Die Epidemiologie und Kontrolle von Acinetobacter baumanii in Gesundheitseinrichtungen. Clinical Infectious Diseases, 42: 692 & ndash; 9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii Multiresistent: aktuelle klinische Situation und neue Perspektiven Revista Española de Quimioterapia, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: Epidemiologie, Antibiotikaresistenz und Behandlungsmöglichkeiten. Clin Infec Dis 2008; 46: 1254 & ndash; 63.
- McConnell, M. J., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: Infektionen beim Menschen, Faktoren, die zur Pathogenese beitragen, und Tiermodelle. FEMS Microbiology Reviews, 37: 130 & ndash; 155.
- Peleg, A. Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: Entstehung eines erfolgreichen Erregers. Clinical Microbiology Reviews, 21 (3): 538 & ndash; 82.
- Vanegas-Múnera, J. M., Roncancio-Villamil, G. & Jiménez-Quiceno, J. N. (2014). Acinetobacter baumannii: klinische Bedeutung, Resistenzmechanismen und Diagnose. CES Medicine Magazine, 28 (2): 233 & ndash; 246.

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.