
Phosphoroxid (v) -Struktur, Eigenschaften, Gewinnung, Verwendung, Risiken

Das Phosphoroxid (v) Es ist ein anorganischer Feststoff, der aus Phosphor (P) und Sauerstoff (O) gebildet wird. Seine empirische Formel lautet P.zweiODER5, während seine korrekte Summenformel P ist4ODER10. Es ist ein sehr hygroskopischer weißer Feststoff, das heißt, er kann sehr leicht Wasser aus der Luft aufnehmen und reagiert sofort damit. Die Reaktion kann gefährlich sein, da sie einen schnellen Temperaturanstieg verursacht.
Seine hohe Neigung, Wasser zu absorbieren, hat dazu geführt, dass es als Trockenmittel in chemischen Labors sowie als Dehydrator einiger Verbindungen verwendet wird, dh um Wasser aus seinen Molekülen zu entfernen..

Phosphoroxid (v) wird auch verwendet, um die Bindungsreaktionen verschiedener Kohlenwasserstoffmoleküle zu beschleunigen, eine Reaktion, die als Kondensation bezeichnet wird. Darüber hinaus können bestimmte organische Säuren in Ester umgewandelt werden.
Es wurde zum Beispiel verwendet, um Benzin zu raffinieren, um Phosphorsäure H herzustellen3PO4, Verbindungen zu erhalten, die dazu dienen, das Feuer zu verzögern, unter anderem Glas für Vakuumanwendungen herzustellen.
Phosphoroxid (v) sollte in dicht verschlossenen Behältern aufbewahrt werden, um zu verhindern, dass es mit Luftfeuchtigkeit in Kontakt kommt. Es ist ätzend und kann Augen, Haut und Schleimhäute schädigen..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Sublimationstemperatur
- 3.5 Dichte
- 3.6 Löslichkeit
- 3.7 Chemische Eigenschaften
- 3.8 Andere Eigenschaften
- 4 Erhalten
- 4.1 Präsenz in der Natur
- 5 Verwendungen
- 5.1 Als Dehydratisierungs- und Trocknungsmittel
- 5.2 In organischen chemischen Reaktionen
- 5.3 Bei der Kraftstoffraffinierung
- 5.4 In verschiedenen Anwendungen
- 6 Risiken
- 7 Referenzen
Struktur
Phosphoroxid (v) besteht aus Phosphor (P) und Sauerstoff (O), wobei Phosphor eine Wertigkeit von +5 und Sauerstoff -2 hat. Das Phosphoroxidmolekül (v) hat vier Phosphor- und zehn Sauerstoffatome und deshalb lautet seine korrekte Molekülformel P.4ODER10.
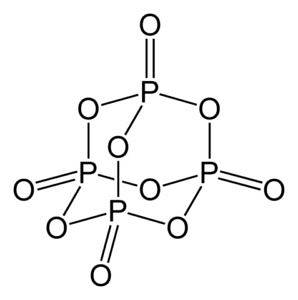
Es liegt in drei kristallinen Formen vor, als amorphes Pulver und in glasartiger Form (als Glas). In der hexagonalen kristallinen Form befindet sich jedes der Phosphoratome an den Eckpunkten eines Tetraeders..
Nomenklatur
- Phosphoroxid (v)
- Phosphorpentoxid
- Diphosphoriges Pentoxid
- Phosphorpentoxid
- Phosphorsäureanhydrid
- Tetraphosphor-Decaoxid
Eigenschaften
Körperlicher Status
Kristalliner weißer Feststoff. Die häufigste Form ist die von hexagonalen Kristallen.
Molekulargewicht
283,89 g / mol
Schmelzpunkt
562 ºC
Sublimationstemperatur
360 ºC bei 1 Atmosphärendruck. Dies bedeutet, dass es bei dieser Temperatur von fest zu gasförmig geht, ohne den flüssigen Zustand zu durchlaufen.
Dichte
2,30 g / cm3
Löslichkeit
Sehr gut wasserlöslich. Löslich in Schwefelsäure. Unlöslich in Aceton und Ammoniak.
Chemische Eigenschaften
Phosphoroxid (v) absorbiert und reagiert extrem schnell mit Wasser in der Luft unter Bildung von Phosphorsäure H.3PO4. Diese Reaktion ist exotherm, was bedeutet, dass während der Reaktion Wärme erzeugt wird..
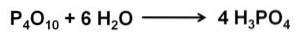
Die Reaktion von P.4ODER10 mit Wasser entsteht ein Gemisch von Phosphorsäuren, deren Zusammensetzung von der Wassermenge und den Bedingungen abhängt.
Die Reaktion mit Alkoholen führt in Abhängigkeit von den Versuchsbedingungen zur Bildung von Estern der Phosphorsäure oder der Polymersäure..
P.4ODER10 + 6 ROH → 2 (RO)zweiPO.OH + 2 RO.PO (OH)zwei
Mit basischen Oxiden bildet es feste Phosphate.
Es ist ätzend. Kann gefährlich mit Ameisensäure und anorganischen Basen wie Natriumhydroxid (NaOH), Calciumoxid (CaO) oder Natriumcarbonat Na reagierenzweiCO3.
Wenn Sie eine Lösung von Perchlorsäure HClO gießen4 und Chloroform CHCl3 in Phosphoroxid (v) P.4ODER10 es kommt zu einer heftigen Explosion.
Andere Eigenschaften
Es ist nicht brennbar. Es fördert nicht die Verbrennung. Die Reaktion mit Wasser ist jedoch so heftig und exotherm, dass Brandgefahr besteht..
Erhalten
Es kann durch direkte Oxidation von Phosphor in einem trockenen Luftstrom hergestellt werden. Phosphor oxidiert bei Kontakt mit überschüssigem Sauerstoff unter Bildung von Phosphoroxid (v).
P.4 + 5 O.zwei → P.4ODER10
Präsenz in der Natur
Phosphor (v) oxid ist in Mineralien wie Ilmenit, Rutil und Zirkon enthalten.
Ilmenit ist ein Mineral, das Eisen und Titan enthält und manchmal Phosphor (v) oxid in Konzentrationen enthält, die zwischen 0,04 und 0,33 Gew .-% variieren. Rutil ist ein Titanoxidmineral und kann etwa 0,02 Gew .-% P enthaltenzweiODER5.
Zirkonsande (ein Mineral des Elements Zirkonium) haben Phosphoroxid (v) in 0,05 bis 0,39 Gew .-%.
Anwendungen
Als Dehydratisierungs- und Trocknungsmittel
Aufgrund seiner großen Gier nach Wasser ist es eines der bekanntesten Dehydratisierungsmittel und bei Temperaturen unter 100 ° C sehr wirksam..
Es kann Wasser aus Substanzen extrahieren, die selbst als Dehydratisierungsmittel gelten. Zum Beispiel können Sie Wasser aus Schwefelsäure H entfernenzweiSW4 es in SO verwandeln3 und Salpetersäure HNO3 es in N verwandelnzweiODER5.

Grundsätzlich kann es alle Flüssigkeiten und Gase trocknen, mit denen es nicht reagiert, sodass Feuchtigkeitsspuren aus Vakuumsystemen entfernt werden können.
In organischen chemischen Reaktionen
Phosphoroxid (v) dient zum Schließen von Ringen organischer Verbindungen und anderer Kondensationsreaktionen.
Es ermöglicht die Veresterung organischer Säuren mit der Möglichkeit, zwischen primären aliphatischen Carbonsäuren (Kohlenstoffkette ohne Ringe mit der -COOH-Gruppe an einem Ende) und aromatischen Säuren (-COOH-Gruppe am Benzolring) zu unterscheiden, da letztere nicht reagieren.
Es dient auch dazu, ein Molekül von H zu entfernenzweiO der Amide R (C = O) NHzwei und wandelt sie in R-CN-Nitrile um. Darüber hinaus katalysiert oder beschleunigt es die Oxygenierungs-, Dehydrierungs- und Polymerisationsreaktionen von Bitumen.

Bei der Kraftstoffraffinierung
Seit den 30er Jahren des 20. Jahrhunderts zeigten bestimmte Studien, dass Phosphor (v) oxid eine raffinierende Wirkung auf Benzin ausübte und dessen Oktanzahl erhöhte.
Die Verfeinerungswirkung von P.4ODER10 Es ist hauptsächlich auf Kondensationsreaktionen (Vereinigung verschiedener Moleküle) und nicht auf Polymerisation (Vereinigung gleicher Moleküle) zurückzuführen..
Die p4ODER10 beschleunigt die direkte Alkylierung aromatischer Kohlenwasserstoffe mit Olefinen, die Umwandlung von Olefinen zu Naphthenen und deren teilweise Polymerisation. Die Alkylierungsreaktion erhöht die Oktanzahl von Benzin.
Auf diese Weise wird ein hochwertiges raffiniertes Benzin erhalten.

In verschiedenen Anwendungen
Phosphoroxid (v) wird verwendet, um:
- Bereiten Sie Phosphorsäure H vor3PO4
- Erhalten Sie Acrylatester und Tenside
- Bereiten Sie Phosphatester vor, die als Flammschutzmittel, Lösungsmittel und Verdünnungsmittel verwendet werden
- Umwandlung von Phosphortrichlorid zu Phosphoroxychlorid
- Laborreagenz
- Stellen Sie Spezialglas für Vakuumröhren her
- Erhöhen Sie den Schmelzpunkt von Asphalt
- Als Standardmolekül bei der Bestimmung von Phosphor oder Phosphaten in Phosphatgestein, Düngemitteln und Portlandzement in Form von P dienenzweiODER5
- Verbessern Sie die Bindungen zwischen bestimmten Polymeren und der Elfenbeinschicht der Zähne

Risiken
Phosphor (v) oxid sollte in verschlossenen Behältern und an kühlen, trockenen und gut belüfteten Orten aufbewahrt werden.
Dies dient dazu, zu verhindern, dass es mit Wasser in Kontakt kommt, da es heftig mit Wasser reagieren und viel Wärme erzeugen kann, bis brennbare Materialien in der Nähe verbrannt werden..
Phosphor (v) oxidstaub reizt die Augen und die Atemwege und wirkt ätzend auf die Haut. Kann Augenverbrennungen verursachen. Verschlucken verursacht tödliche innere Verbrennungen.
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Phosphorsäureanhydrid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Nayler, P. (2001). Bitumen: Geändert. Chemische Modifikation. In der Encyclopedia of Materials: Wissenschaft und Technologie. Von sciencedirect.com wiederhergestellt.
- Malishev, B.W. (1936). Phosphorpentoxid als Raffiniermittel für Benzin. Industrial & Engineering Chemistry 1936, 28, 2, 190-193. Von pubs.acs.org wiederhergestellt.
- Epps, Jr. E.A. (1950). Photometrische Bestimmung des verfügbaren Phosphorpentoxids in Düngemitteln. Analytical Chemistry 1950, 22, 8, 1062 & ndash; 1063. Von pubs.acs.org wiederhergestellt.
- Banerjee, A. et al. (1983). Verwendung von Phosphorpentoxid: Veresterung organischer Säuren. J. Org. Chem. 1983, 48, 3108 & ndash; 3109. Von pubs.acs.org wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Sons.
- Ogliari, F.A. et al. (2008). Synthese von Phosphatmonomeren und Bindung an Dentin: Veresterungsmethoden und Verwendung von Phosphorpentoxid. Journal of Dentistry, Band 36, Ausgabe 3, März 2008, Seiten 171-177. Von sciencedirect.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.