
Struktur, Eigenschaften, Risiken und Verwendungen von Schwefeltrioxid (SO3)

Das Schwefeltrioxid Es ist eine anorganische Verbindung, die durch die Vereinigung eines Schwefelatoms (S) und 3 Sauerstoffatomen (O) gebildet wird. Seine Summenformel lautet SO3. Bei Raumtemperatur SO3 Es ist eine Flüssigkeit, die Gase in die Luft abgibt.
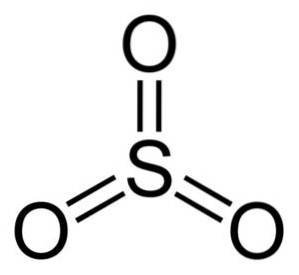
Die Struktur des Betriebssystems3 gasförmig ist flach und symmetrisch. Alle drei Sauerstoffatome befinden sich gleichermaßen um Schwefel. Die SO3 Reagiert heftig mit Wasser. Die Reaktion ist exotherm, was bedeutet, dass Wärme erzeugt wird, mit anderen Worten, es wird sehr heiß.
Wenn die SO3 Flüssigkeit kühlt ab und verwandelt sich in einen Feststoff, der drei Arten von Strukturen aufweisen kann: Alpha, Beta und Gamma. Am stabilsten ist Alpha in Form von Schichten, die zu einem Netzwerk zusammengefügt sind.
Gasförmiges Schwefeltrioxid wird zur Herstellung von rauchender Schwefelsäure, auch Oleum genannt, verwendet, da es Öl oder öligen Substanzen ähnelt. Eine weitere wichtige Anwendung ist die Sulfonierung organischer Verbindungen, dh die Addition von -SO-Gruppen3- zu diesen. So können unter anderem nützliche Chemikalien wie Waschmittel, Farbstoffe, Pestizide hergestellt werden..
Die SO3 Es ist sehr gefährlich, es kann schwere Verbrennungen, Augen- und Hautschäden verursachen. Es sollte auch nicht eingeatmet oder eingenommen werden, da es durch innere Verbrennungen, Mund, Speiseröhre, Magen usw. zum Tod führen kann..
Aus diesen Gründen muss mit großer Vorsicht umgegangen werden. Es darf niemals mit Wasser oder brennbaren Materialien wie Holz, Papier, Stoffen usw. in Kontakt kommen, da es zu Bränden kommen kann. Aufgrund der Explosionsgefahr darf es weder entsorgt noch in die Kanalisation gelangen.
Die SO3 In industriellen Prozessen erzeugte Gase sollten nicht in die Umwelt freigesetzt werden, da sie für den sauren Regen verantwortlich sind, der bereits große Waldflächen auf der Welt beschädigt hat.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Physikalische Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dreifachpunkt
- 3.5 Siedepunkt
- 3.6 Dichte
- 3.7 Dampfdruck
- 3.8 Stabilität
- 4 Chemische Eigenschaften
- 5 Erhalten
- 6 Verwendungen
- 6.1 Bei der Herstellung von Oleum
- 6.2 Bei der Sulfonierung chemische Reaktionen
- 6.3 Bei der Gewinnung von Metallen
- 6.4 In verschiedenen Anwendungen
- 7 Risiken
- 7.1 Für die Gesundheit
- 7.2 Durch Feuer oder Explosion
- 8 Umweltauswirkungen
- 9 Referenzen
Struktur
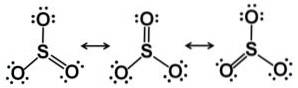
Das Schwefeltrioxidmolekül SO3 im gasförmigen Zustand hat es eine flache dreieckige Struktur.
Dies bedeutet, dass sich sowohl Schwefel als auch die drei Sauerstoffatome in derselben Ebene befinden. Darüber hinaus ist die Verteilung von Sauerstoff und allen Elektronen symmetrisch.
Im festen Zustand sind drei Arten von Strukturen des SO bekannt3: alpha (α-SO3), beta (β-SO3) und Gamma (γ-SO3).
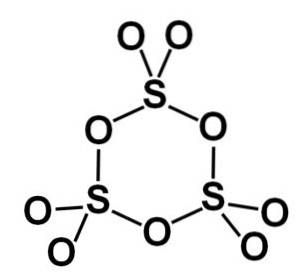
Die Gamma-γ-SO-Form3 enthält cyclische Trimere, dh drei Einheiten SO3 zusammen ein cyclisches oder ringförmiges Molekül bilden.
Die Beta-Phase β-SO3 besitzt unendliche helikale Ketten von Tetraedern der Zusammensetzung SO4 miteinander verbunden.
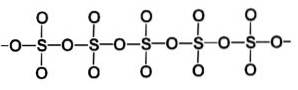
Die stabilste Form ist alpha α-SO3, Ähnlich wie Beta, jedoch mit einer Schichtstruktur, wobei die Ketten zu einem Netzwerk verbunden sind.
Nomenklatur
-Schwefeltrioxid
-Schwefelsäureanhydrid
-Schwefeloxid
-SW3 Gamma, γ-SO3
-SW3 Beta, β-SO3
-SW3 alpha, α-SO3
Physikalische Eigenschaften
Körperlicher Status
Bei Raumtemperatur (ca. 25 ºC) und atmosphärischem Druck wird SO3 Es ist eine farblose Flüssigkeit, die Dämpfe in die Luft abgibt.
Wenn die SO3 Flüssigkeit ist bei 25 ºC rein, es ist eine Mischung aus SO3 monomer (Einzelmolekül) und trimer (3 Moleküle gebunden) der Formel S.3ODER9, auch SO genannt3 Gamma γ-SO3.
Wenn die Temperatur sinkt, wenn die SO3 es ist rein, wenn es 16,86 ºC erreicht, es verfestigt sich oder gefriert zu γ-SO3, auch "SO Eis" genannt3"".
Wenn es geringe Mengen an Feuchtigkeit enthält (auch Spuren oder extrem kleine Mengen), wird die SO3 polymerisiert zur Beta-β-SO-Form3 das bildet Kristalle mit einem seidigen Glanz.
Dann werden mehr Bindungen gebildet, wodurch die Alpha-α-SO-Struktur erzeugt wird3, Dies ist ein nadelförmiger kristalliner Feststoff, der Asbest oder Asbest ähnelt.
Wenn Alpha und Beta verschmelzen, erzeugen sie Gamma.
Molekulargewicht
80,07 g / mol
Schmelzpunkt
SW3 Gamma = 16,86 ºC
Dreifacher Punkt
Es ist die Temperatur, bei der die drei physikalischen Zustände vorliegen: fest, flüssig und gasförmig. In der Alpha-Form liegt der Tripelpunkt bei 62,2 ºC und in der Beta bei 32,5 ºC.
Das Erhitzen der Alpha-Form neigt eher zum Sublimieren als zum Schmelzen. Sublimieren bedeutet, direkt vom festen in den gasförmigen Zustand überzugehen, ohne den flüssigen Zustand zu durchlaufen.
Siedepunkt
Alle Formen von Betriebssystemen3 bei 44,8 ºC kochen.
Dichte
Die SO3 Flüssigkeit (Gamma) hat eine Dichte von 1,9225 g / cm3 bei 20 ºC.
Die SO3 gasförmig hat eine Dichte von 2,76 relativ zu Luft (Luft = 1), was darauf hinweist, dass es schwerer als Luft ist.
Dampfdruck
SW3 alpha = 73 mm Hg bei 25 ºC
SW3 Beta = 344 mm Hg bei 25 ºC
SW3 gamma = 433 mm Hg bei 25 ºC
Dies bedeutet, dass die Gammaform dazu neigt, leichter zu verdampfen als Beta und dies als Alpha..
Stabilität
Die Alpha-Form ist die stabilste Struktur, die anderen sind metastabil, dh sie sind weniger stabil.
Chemische Eigenschaften
Die SO3 reagiert heftig mit Wasser zu Schwefelsäure H.zweiSW4. Bei der Reaktion entsteht viel Wärme, weshalb schnell Wasserdampf aus dem Gemisch freigesetzt wird.
Der Luft ausgesetzt sein die SO3 nimmt Feuchtigkeit schnell auf und gibt dichte Dämpfe ab.
Es ist ein sehr starkes Dehydratisierungsmittel, das heißt, es entfernt leicht Wasser von anderen Materialien.
Schwefel in SO3 hat eine Affinität zu freien Elektronen (dh Elektronen, die nicht in einer Bindung zwischen zwei Atomen stehen), so dass es dazu neigt, Komplexe mit Verbindungen zu bilden, die sie besitzen, wie Pyridin, Trimethylamin oder Dioxan.
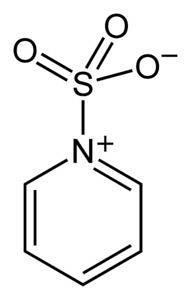
Durch die Bildung von Komplexen "leiht" Schwefel Elektronen von der anderen Verbindung, um deren Mangel zu füllen. Schwefeltrioxid ist in diesen Komplexen noch verfügbar, die in chemischen Reaktionen zur Bereitstellung von SO verwendet werden3.
Es ist ein starkes Sulfonierungsmittel für organische Verbindungen, was bedeutet, dass es leicht zum Hinzufügen einer -SO-Gruppe verwendet wird3- zu Molekülen.
Reagiert leicht mit den Oxiden vieler Metalle, um Sulfate dieser Metalle zu ergeben.
Es ist ätzend für Metalle, tierische und pflanzliche Gewebe.
Die SO3 Es ist aus mehreren Gründen schwierig zu handhaben: (1) sein Siedepunkt ist relativ niedrig, (2) es neigt dazu, bei Temperaturen unter 30ºC feste Polymere zu bilden, und (3) es hat eine hohe Reaktivität gegenüber fast allen organischen Stoffen Substanzen und das Wasser.
Es kann explosionsartig polymerisieren, wenn es keinen Stabilisator enthält und Feuchtigkeit vorhanden ist. Als Stabilisatoren werden Dimethylsulfat oder Boroxid verwendet..
Erhalten
Es wird durch die Reaktion bei 400 ºC zwischen Schwefeldioxid SO erhaltenzwei und molekularer Sauerstoff O.zwei. Die Reaktion ist jedoch sehr langsam und Katalysatoren sind erforderlich, um die Reaktionsgeschwindigkeit zu erhöhen..
2 SOzwei + ODERzwei SO 2 SO3
Zu den Verbindungen, die diese Reaktion beschleunigen, gehört das Platinmetall Pt, Vanadiumpentoxid V.zweiODER5, Eisenoxid FezweiODER3 und Stickoxid NO.
Anwendungen
Bei der Herstellung von Oleum
Eine seiner Hauptanwendungen ist die Herstellung von Oleum oder rauchender Schwefelsäure, die so genannt wird, weil sie mit bloßem Auge sichtbare Dämpfe abgibt. Um es zu erhalten, wird das SO absorbiert3 in konzentrierter Schwefelsäure H.zweiSW4.

Dies geschieht in speziellen Edelstahltürmen, in denen die konzentrierte Schwefelsäure (die flüssig ist) und die SO abfällt3 Soda steigt.
Die Flüssigkeit und das Gas kommen in Kontakt und bilden zusammen Oleum, eine ölig aussehende Flüssigkeit. Dies besitzt eine Mischung von H.zweiSW4 Und so3, es hat aber auch Schwefelsäuremoleküle H.zweiS.zweiODER7 und Trisulfuric H.zweiS.3ODER10.
Bei der Sulfonierung chemische Reaktionen
Die Sulfonierung ist ein Schlüsselverfahren in industriellen Großanwendungen zur Herstellung von Waschmitteln, Tensiden, Farbstoffen, Pestiziden und Pharmazeutika..
Die SO3 es dient unter anderem als Sulfonierungsmittel zur Herstellung sulfonierter Öle und alkylarylsulfonierter Detergenzien. Das Folgende zeigt die Sulfonierungsreaktion einer aromatischen Verbindung:
ArH + SO3 → ArSO3H.
Oleum oder SO können für Sulfonierungsreaktionen verwendet werden.3 unter anderem in Form seiner Komplexe mit Pyridin oder mit Trimethylamin.
Bei der Gewinnung von Metallen
SO Gas3 Es wurde zur Behandlung von Mineralien verwendet. Einfache Oxide von Metallen können durch Behandlung mit SO zu viel löslicheren Sulfaten werden3 bei relativ niedrigen Temperaturen.
Sulfidmineralien wie Pyrit (Eisensulfid), Chalcosin (Kupfersulfid) und Millerit (Nickelsulfid) sind die wirtschaftlichsten Quellen für Nichteisenmetalle3 ermöglicht die einfache und kostengünstige Gewinnung dieser Metalle.
Eisen-, Nickel- und Kupfersulfide reagieren mit SO-Gas3 selbst bei Raumtemperatur bilden sich die jeweiligen Sulfate, die sehr gut löslich sind und anderen Verfahren unterzogen werden können, um das reine Metall zu erhalten.
In verschiedenen Anwendungen
Die SO3 verwendet zur Herstellung von Chlorsulfonsäure, auch Chlorsulfonsäure HSO genannt3Cl.
Schwefeltrioxid ist ein sehr starkes Oxidationsmittel und wird zur Herstellung von Sprengstoffen verwendet..
Risiken
Für die Gesundheit
Die SO3 Es ist auf allen Wegen eine hochgiftige Verbindung, dh Einatmen, Verschlucken und Kontakt mit der Haut.
Reizende und korrodierende Schleimhäute. Verursacht Haut- und Augenverbrennungen. Seine Dämpfe sind beim Einatmen sehr giftig. Innere Verbrennungen, Atemnot, Brustschmerzen und Lungenödeme treten auf.

Es ist giftig. Seine Einnahme verursacht schwere Verbrennungen des Mundes, der Speiseröhre und des Magens. Darüber hinaus wird vermutet, dass es krebserregend ist.
Vor Feuer oder Explosion
Es stellt eine Brandgefahr dar, wenn es mit Materialien organischen Ursprungs wie Holz, Fasern, Papier, Öl, Baumwolle usw. in Kontakt kommt, insbesondere wenn diese nass sind..
Es besteht auch ein Risiko, wenn Sie mit Basen oder Reduktionsmitteln in Kontakt kommen. Verbindet sich explosionsartig mit Wasser und bildet Schwefelsäure.
Kontakt mit Metallen kann Wasserstoffgas H erzeugenzwei das ist sehr brennbar.
Das Erhitzen in Gläsern sollte vermieden werden, um einen möglichen gewaltsamen Bruch des Behälters zu verhindern..
Umweltbelastung
Die SO3 Es gilt als einer der Hauptschadstoffe in der Erdatmosphäre. Dies ist auf seine Rolle bei der Bildung von Aerosolen und seinen Beitrag zum sauren Regen (aufgrund der Bildung von Schwefelsäure H) zurückzuführenzweiSW4).

Die SO3 wird in der Atmosphäre durch Oxidation von Schwefeldioxid SO gebildetzwei. Bei der Bildung der SO3 es reagiert schnell mit Wasser unter Bildung von Schwefelsäure H.zweiSW4. Jüngsten Studien zufolge gibt es andere Mechanismen der Transformation von SO3 in der Atmosphäre, aber aufgrund der großen Menge an Wasser, die darin vorhanden ist, wird es immer noch als viel wahrscheinlicher angesehen, dass SO3 wird in erster Linie H.zweiSW4.
Die SO3 Gas oder gasförmige Industrieabfälle, die es enthalten, sollten nicht in die Atmosphäre eingeleitet werden, da es sich um einen gefährlichen Schadstoff handelt. Es ist ein hochreaktives Gas und, wie bereits gesagt, in Gegenwart von Luftfeuchtigkeit SO3 wird zu Schwefelsäure H.zweiSW4. Daher ist in der Luft die SO3 bleibt in Form von Schwefelsäure bestehen und bildet kleine Tröpfchen oder Aerosole.
Wenn die Schwefelsäuretröpfchen in die Atemwege von Menschen oder Tieren gelangen, wachsen sie aufgrund der dort vorhandenen Feuchtigkeit schnell an Größe, sodass sie die Möglichkeit haben, in die Lunge einzudringen. Einer der Mechanismen, durch die der Säurenebel von H.zweiSW4 (d. h. SO3) kann eine starke Toxizität hervorrufen, da es den extrazellulären und intrazellulären pH-Wert lebender Organismen (Pflanzen, Tiere und Menschen) verändert..
Laut einigen Forschern Nebel von SO3 Es ist die Ursache für die Zunahme von Asthmatikern in einem Gebiet Japans. SO Nebel3 Es wirkt sehr korrosiv auf Metalle, so dass von Menschen gebaute Metallstrukturen wie einige Brücken und Gebäude stark beeinträchtigt werden können..
Die SO3 Flüssigkeit darf nicht in Abwasserkanälen oder Abwasserkanälen entsorgt werden. Wenn es in die Kanalisation gelangt, besteht Brand- oder Explosionsgefahr. Richten Sie bei versehentlichem Verschütten keinen Wasserstrahl auf das Produkt. Es sollte niemals in Sägemehl oder anderen brennbaren Absorptionsmitteln absorbiert werden, da dies zu Bränden führen kann.
Es muss in trockenem Sand, trockener Erde oder einem anderen vollständig trockenen inerten Absorptionsmittel absorbiert werden. Die SO3 Es darf nicht in die Umwelt freigesetzt werden und darf niemals damit in Kontakt kommen. Es sollte von Wasserquellen ferngehalten werden, da es dabei Schwefelsäure produziert, die für Wasser- und Landorganismen schädlich ist.
Verweise
- Sarkar, S. et al. (2019). Einfluss von Ammoniak und Wasser auf das Schicksal von Schwefeltrioxid in der Troposphäre: Theoretische Untersuchung der Bildungswege von Sulfaminsäure und Schwefelsäure. J Phys Chem A. 2019; 123 (14): 3131 & ndash; 3141. Von ncbi.nlm.nih.gov wiederhergestellt.
- Muller, T.L. (2006). Schwefelsäure und Schwefeltrioxid. Kirk-Othmer Encyclopedia of Chemical Technology. Band 23. Von onlinelibrary.wiley.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Schwefeltrioxid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Kikuchi, R. (2001). Umweltmanagement der Schwefeltrioxidemission: Auswirkungen von SO3 auf die menschliche Gesundheit. Environmental Management (2001) 27: 837. Von link.springer.com wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Ismail, M.I. (1979). Extraktion von Metallen aus Sulfiden mit Schwefeltrioxid im Wirbelbett. J. Chem. Tech. Biotechnol. 1979, 29, 361 & ndash; 366. Von onlinelibrary.wiley.com wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.