
Struktur, Eigenschaften und Verwendung von Arsentrioxid (As2O3)
Das Arsentrioxid ist eine anorganische Verbindung mit der chemischen Formel AszweiODER3. Arsen in seinem metallischen Zustand wird schnell in dieses Oxid umgewandelt, das ein sehr giftiges Gift ist, das akute und chronische Manifestationen haben kann..
Da Arsen und Sauerstoff Elemente des p-Blocks mit einem relativ geringen Elektronegativitätsunterschied sind, wird erwartet, dass AszweiODER3 besteht aus einer kovalenten Natur; das heißt, dass die As-O-Bindungen in ihrem Feststoff gegenüber den elektrostatischen Wechselwirkungen zwischen den As-Ionen überwiegen3+ michzwei-.

Eine akute Vergiftung mit Arsentrioxid tritt durch Verschlucken oder Einatmen auf. Die wichtigsten Manifestationen sind: schwere Magen-Darm-Störungen, Krämpfe, Kreislaufkollaps und Lungenödem..
Trotz seiner Toxizität wurde es jedoch industriell verwendet; zum Beispiel bei der Konservierung von Holz, bei der Herstellung von Pigmenten, Halbleitern usw. Ebenso wurde es früher zur Behandlung zahlreicher Krankheiten eingesetzt.
Arsentrioxid ist eine amphotere Verbindung, die in verdünnten Säuren und Laugen löslich, in organischen Lösungsmitteln unlöslich und in Wasser relativ löslich ist. Es tritt als Feststoff (oberes Bild) mit zwei kristallinen Formen auf: kubisch und monoklin.
Artikelverzeichnis
- 1 Struktur von Arsentrioxid
- 1.1 Claudetite
- 1.2 Flüssig und gasförmig
- 1.3 Arsenolith
- 2 Eigenschaften
- 2.1 Handelsnamen
- 2.2 Molekulargewicht
- 2.3 Aussehen
- 2.4 Geruch
- 2.5 Geschmack
- 2.6 Siedepunkt
- 2.7 Schmelzpunkt
- 2.8 Flammpunkt
- 2.9 Löslichkeit in Wasser
- 2.10 Löslichkeit
- 2.11 Dichte
- 2.12 Dampfdruck
- 2.13 Zersetzung
- 2.14 Korrosivität
- 2.15 Verdampfungswärme
- 2.16 Dissoziationskonstante (Ka)
- 2.17 Brechungsindex
- 3 Reaktivität
- 4 Nomenklatur
- 5 Verwendungen
- 5.1 Industrie
- 5.2 Ärzte
- 6 Referenzen
Struktur von Arsentrioxid
Claudetita
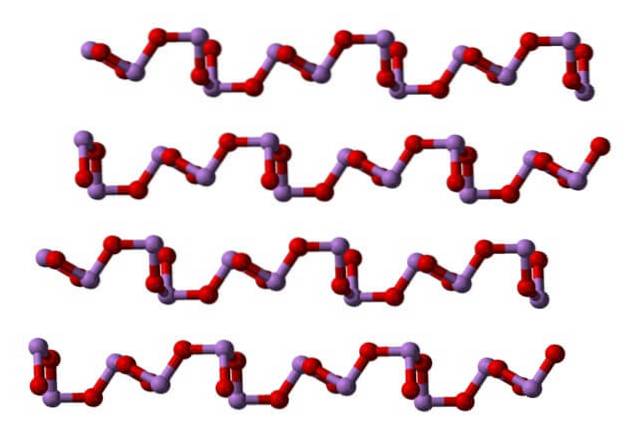
Bei Raumtemperatur wird AszweiODER3 kristallisiert in zwei monokline Polymorphe, die beide im Mineral Claudetit enthalten sind. Sie haben trigonale Pyramideneinheiten AsO3, die durch ihre Sauerstoffatome verbunden sind, um den elektronischen Mangel der Einheit selbst zu kompensieren.
In einem Polymorph die AsO-Einheiten3 Sie sind zu Reihen verbunden (Claudetit I), und in der anderen sind sie so verbunden, als würden sie ein Netz weben (Claudetit II):
Flüssig und gasförmig
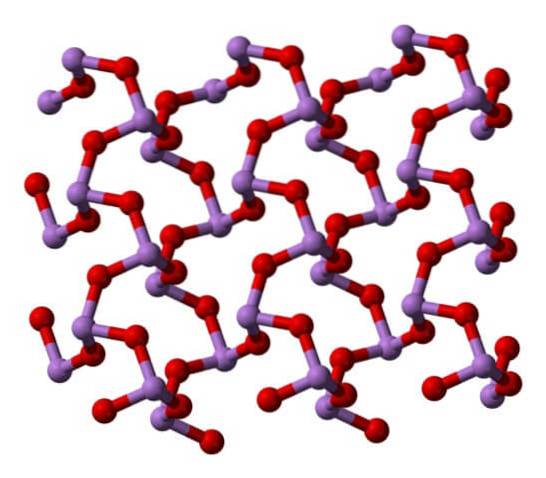
Wenn alle Strukturen, die monokline Kristalle definieren, erhitzt werden, sind die Schwingungen so, dass mehrere As-O-Bindungen aufgebrochen werden und ein kleineres Molekül am Ende vorherrscht: As4ODER6. Seine Struktur ist im Bild unten dargestellt.

Man könnte sagen, dass es aus einem Dimer von As bestehtzweiODER3. Seine Stabilität ist so, dass es 800 ° C in der Gasphase unterstützt; oberhalb dieser Temperatur fragmentiert es jedoch in As-MolekülezweiODER3.
Arsenolit
Das gleiche Ass4ODER6 können miteinander interagieren, um zu einem kubischen Feststoff zu kristallisieren, dessen Struktur sich im Mineral Arsenolit befindet.
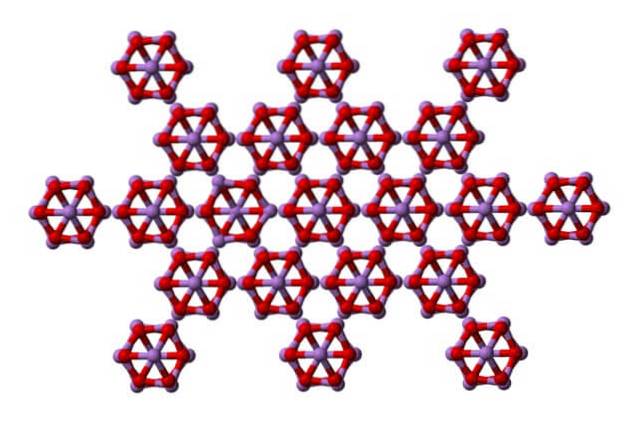
Beachten Sie, dass das Bild die Struktur von einer höheren Ebene zeigt. Im Vergleich zu Clauditit ist der strukturelle Unterschied zu Arsenolit offensichtlich. Hier sind sie diskrete Moleküle von As4ODER6 Diese Einheiten werden von Van-der-Waals-Kräften unterhalten.
Eigenschaften
Namen austauschen
-Arsenolit
-Arsodent
-Trisenox
-Claudetita
Molekulargewicht
197,84 g / mol.
Aussehen
-Weiße kubische Kristalle (Arsenolit).
-Farblose monokline Kristalle (Claudetit).
-Weiße oder transparente feste, glasartige, amorphe Klumpen oder kristallines Pulver.
Geruch
Toilette.
Geschmack
Geschmacklos.
Siedepunkt
460 ºC.
Schmelzpunkt
-313 ºC (Claudetit).
-274 ºC (Arsenolit).
Zündpunkt
485 º C (sublimiert).
Wasserlöslichkeit
17 g / l bei 18 ºC (20 g / l bei 25 ºC).
Löslichkeit
Löslich in Säuren (insbesondere Salzsäure) und Laugen. Praktisch unlöslich in Chloroform und Ether.
Dichte
-3,85 g / cm3 (kubische Kristalle);
-4,15 g / cm3 (rhombische Kristalle).
Dampfdruck
2,47 10-4 mmHg bei 25 ºC.
Zersetzung
Es ist nicht brennbar, kann aber beim Erhitzen giftigen Rauch erzeugen, der Arsin enthalten kann..
Korrosivität
In Gegenwart von Feuchtigkeit kann es für Metalle ätzend sein.
Verdampfungswärme
77 kJ / mol.
Dissoziationskonstante (Ka)
1.110-4 bei 25 ºC.
Brechungsindex
-1.755 (Arsenolit)
-1,92-2,01 (Claudetit).
Reaktivität
-Arsentrioxid ist eine amphotere Verbindung, wirkt jedoch bevorzugt als Säure.
-Kann mit Salzsäure oder Flusssäure unter Bildung von Arsentrichlorid oder Arsentrifluorid reagieren.
-Ebenso reagiert es mit starken Oxidationsmitteln wie Salpetersäure und verursacht Arsen und Lachgas..
-Arsentrioxid kann je nach Reaktionsbedingungen mit Salpetersäure unter Bildung von Arsin oder dem Element Arsen reagieren..
AszweiODER3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (NR3)zwei + 3 H.zweiODER.
Diese Reaktion diente als Grundlage für die Erstellung des Marsh-Tests zum Nachweis von Arsenvergiftungen..
Nomenklatur
BeimzweiODER3 Es kann nach den folgenden Nomenklaturen benannt werden, wobei bekannt ist, dass Arsen mit Valenz +3 wirkt:
-Arsenoxid (traditionelle Nomenklatur).
-Arsen (III) -oxid (Stammnomenklatur).
-Diarsen-Trioxid (systematische Nomenklatur).
Anwendungen
Industriell
-Es wird bei der Herstellung von Glas verwendet, insbesondere als Bleichmittel. Es wird auch zur Herstellung von Keramik, elektronischen Produkten und Feuerwerkskörpern verwendet.
-Es wird Kupferlegierungen als Nebenbestandteil zugesetzt, um die Korrosionsbeständigkeit der Legierungsmetalle zu erhöhen.
-Das AsszweiODER3 ist das Ausgangsmaterial für die Herstellung von elementarem Arsen, zur Verbesserung der elektrischen Verbindungen und für die Herstellung von Arsenidhalbleitern
-Das AsszweiODER3, Neben Kupferarsenat werden sie als Holzschutzmittel eingesetzt. Es wurde in Kombination mit Kupferacetat verwendet, um das grüne Pariser Pigment herzustellen, das zur Herstellung von Farben und Rodentiziden verwendet wurde..
Ärzte
-Arsentrioxid ist eine Verbindung, die seit Jahrhunderten zur Behandlung vieler Krankheiten eingesetzt wird. Es wurde als Tonikum bei der Behandlung von Ernährungsstörungen, Neuralgie, Rheuma, Arthritis, Asthma, Chorea, Malaria, Syphilis und Tuberkulose eingesetzt.
-Ebenso wurde es bei der lokalen Behandlung von Hautkrankheiten eingesetzt, um einige oberflächliche Epitheliome zu zerstören..
-Fowlers Lösung wurde zur Behandlung von Hautkrankheiten und Leukämie verwendet. Die Anwendung dieses Arzneimittels wird eingestellt..
-In den 1970er Jahren forschte der chinesische Forscher Zhang Tingdong über die Verwendung von Arsentrioxid bei der Behandlung der akuten Promyelozyten-Leukämie (APL). Was zur Herstellung des von der US-amerikanischen FDA zugelassenen Arzneimittels Trisenox führte.
-Trisenox wurde bei APL-Patienten angewendet, die nicht auf eine "First-Line" -Behandlung ansprechen, die aus all-trans-Retinsäure (ATRA) besteht. Es wurde gezeigt, dass Arsentrioxid Krebszellen dazu veranlasst, Apoptose zu erleiden.
-Trisenox wird als Zytostatikum bei der Behandlung des refraktären Promyelozyten-Subtyps (M) verwendet3) von APL.
Verweise
- Shen et al. (2001). Studien zur klinischen Wirksamkeit und Pharmakokinetik von niedrig dosiertem Arsentrioxid bei der Behandlung von rezidivierter akuter promyelozytischer Leukämie: ein Vergleich mit der konventionellen Dosierung. Leukemia 15, 735 & ndash; 741.
- Science Direct. (2014). Arsentrioxid. Der Sevier. Wiederhergestellt von: sciencedirect.com
- Wikipedia. (2019). Arsentrioxid. Wiederhergestellt von: en.wikipedia.org
- PubChem. (2019). Arsen (III) -oxid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta und Steven L. Soignetb. (2001). Risiko-Nutzen-Profil von Arsentrioxid. Der Onkologe vol. 6 Beilage 2 29-32.
- Das New England Journal of Medicine. (11. Juli 2013). Retinsäure und Arsentrioxid bei akuter promyelozytischer Leukämie. n engl j med 369; 2.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.